题目内容
20.常温下,对于pH=11的NaOH溶液,下列说法错误的是( )| A. | c(OH-)=c(Na+)+c(H+) | |
| B. | 该溶液中的c(OH-)=1.0x10-3mol•L-1 | |
| C. | 加水稀释104倍所得溶液显碱性 | |
| D. | 与pH=3的HF溶液等体积混合所得溶液:c(Na+)=c (F-)+c(HF) |
分析 A.根据溶液中的电荷守恒进行判断;
B.氢氧化钠溶液中氢离子的浓度为水电离产生,根据水的离子积计算;
C.碱溶液加水稀释后不会变成中性或酸性溶液,仍然为碱性溶液;
D.氟化氢为弱电解质,混合液中HF过量,则c(Na+)<c (F-)+c(HF).
解答 解:A.根据电荷守恒,溶液中阳离子所带电荷等于阴离子所带电荷,即:c(OH-)=c(Na+)+c(H+),故A正确;
B.氢氧化钠溶液中氢离子的浓度为水电离产生,pH=11的NaOH溶液中c(H+)=1.0×10-11mol•L-1,根据水的离子积常数,溶液中氢氧根离子的浓度为:c(OH-)=1.0×10-3mol•L-1,故B正确;
C.该氢氧化钠溶液中c(OH-)=1.0×10-3mol•L-1,加水稀释104倍所得溶液中,氢氧根离子只能接近1.0×10-7mol•L-1,溶液仍然为碱性溶液,故C正确;
D.pH=3的HF溶液中,HF的浓度大于0.001mol/L,两溶液等体积混合后,HF过量,则:c(Na+)<c (F-)+c(HF),故D错误;
故选D.
点评 本题考查溶液中离子浓度的比较、酸碱混合的定性判断、弱电解质的电离平衡及其影响等知识,题目难度中等,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
相关题目
10.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.请回答:
(1)编号元素中,化学性质最不活泼元素的原子结构示意图是Ne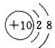 .
.
(2)九种元素中非金属性最强的是F(填元素符号),元素⑧的氢化物的电子式为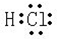 ,
,
(3)除⑨外,原子半径最大的是Na(填元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).电子式为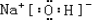 ,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(4)⑥⑦⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S.(用相应的氢化物的化学式作答)
(5)元素④对应的氢化物的化学式是NH3,电子式为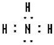 ,其水溶液的pH>7(填“<”或“>”).
,其水溶液的pH>7(填“<”或“>”).
(6)⑦⑧两种元素对应的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2SO4.(用相应的最高价氧化物对应水化物的化学式作答)
(7)①的阳离子与⑥的阴离子的电子层结构与⑨元素的原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(用相应离子符号作答).
(8)这些元素的最高价氧化物对应水化物呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
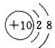 .
.(2)九种元素中非金属性最强的是F(填元素符号),元素⑧的氢化物的电子式为
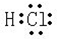 ,
,(3)除⑨外,原子半径最大的是Na(填元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式).电子式为
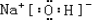 ,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
,所含有的化学键类型有离子键、极性共价键,(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).(4)⑥⑦⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S.(用相应的氢化物的化学式作答)
(5)元素④对应的氢化物的化学式是NH3,电子式为
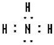 ,其水溶液的pH>7(填“<”或“>”).
,其水溶液的pH>7(填“<”或“>”).(6)⑦⑧两种元素对应的最高价含氧酸的酸性由强到弱的顺序是HClO4>H2SO4.(用相应的最高价氧化物对应水化物的化学式作答)
(7)①的阳离子与⑥的阴离子的电子层结构与⑨元素的原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(用相应离子符号作答).
(8)这些元素的最高价氧化物对应水化物呈两性的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
11.某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种.若在该溶液中逐滴加入稀盐酸至过量无明显现象,并得到X溶液,对X溶液进行如下实验:(已知该题忽略水的电离,且原溶液中各离子浓度均为0.5mol•L-1).下列结论正确的是( )
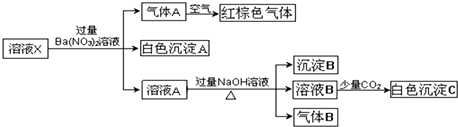

| A. | 原溶液中可能含有NO3-和Al3+ | |
| B. | 白色沉淀C可能是Al(OH)3 | |
| C. | 原溶液中一定存在NH4+、Fe2+、SO42-、Cl- | |
| D. | 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物 |
8.常温下,下列溶液中各微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| B. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ | |
| C. | 0.2mol/L的NaHCO3溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+) | |
| D. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
15.下列实验装置进行相应的实验,能达到实验目的是( )
| A. | 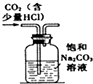 图装置:除去二氧化碳中的少量氯化氢气体 | |
| B. | 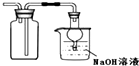 图装置:收集二氧化硫并吸收尾气 | |
| C. |  图装置:用酸性高锰酸钾溶液滴定过氧化氢溶液 | |
| D. |  图装置:用水吸收氯化氢气体并防止倒吸 |
5.关于下列各实验装置的叙述中,不正确的是( )
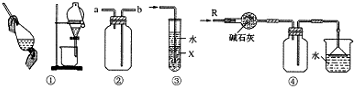

| A. | 装置①可用于分离苯和水的化合物 | |
| B. | 装置②可用于排气法收集H2、CO2、Cl2、NO、NO2等气体 | |
| C. | 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| D. | 装置④可用于干燥、收集NH3,并吸收多余的NH3 |
12.化学在生产生活中有重要作用,下列说法正确的是( )
| A. | 碘有智力元素之称,所以应该大量服用补碘药片 | |
| B. | 汽车尾气中的氮氧化物是汽油不完全燃烧产生的 | |
| C. | 二氧化硫可用于食品防腐,但不能用于食品漂白 | |
| D. | “辽宁舰”上使用的特种钢缆属于新型无机非金属材料 |
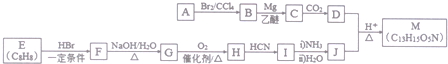
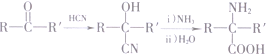 (R′表示氢原子或烃基)
(R′表示氢原子或烃基)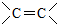 ,
, .
.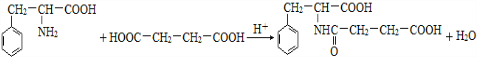 .
.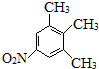 、
、 (不考虑立体异构).
(不考虑立体异构).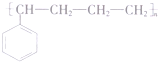 的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO$→_{催化剂/△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}/△}^{CH_{3}OH}$CH3COOCH3.
的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO$→_{催化剂/△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}/△}^{CH_{3}OH}$CH3COOCH3.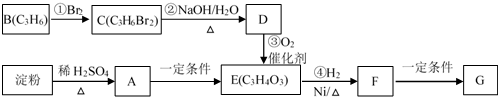
 .
.