题目内容
该同学利用制得的CuSO4溶液及如图所示装置,进行以下实验探究。

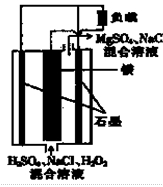
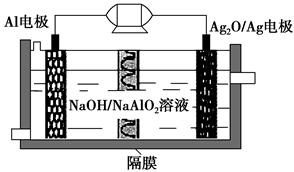
图一 图二
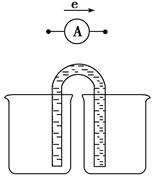
(1)图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是_____________________________________________________,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向________(填“甲”或“乙”)池移动。
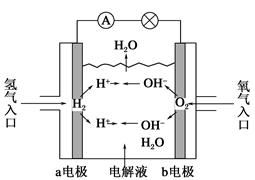
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应是_____________________________________________;
当铜电极的质量减轻3.2 g时,消耗的CH4在标准状况下的体积为________L。

图一 图二
(1)图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是_____________________________________________________,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向________(填“甲”或“乙”)池移动。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应是_____________________________________________;
当铜电极的质量减轻3.2 g时,消耗的CH4在标准状况下的体积为________L。
(1)Cu2++2e-=Cu 乙
(2)O2 CH4-8e-+10OH-=CO32—+7H2O 0.28
(2)O2 CH4-8e-+10OH-=CO32—+7H2O 0.28
(1)铜锌原电池中,较不活泼的铜作正极,正极发生还原反应,即Cu极的电极反应式为Cu2++2e-=Cu,原电池工作时,阳离子向正极方向移动,即向乙池移动。(2)要想实现铁上镀铜,则铁作阴极,铜作阳极,即b处电极为正极,a处电极为负极,则b处通O2;a处电极上发生氧化反应,即CH4-8e-+10OH-=CO32—+7H2O。由电子守恒可知,铜电极质量减轻3.2 g,即0.05 mol Cu参与反应,转移电子0.1 mol,则:
CH4 ~ 8e-
22.4 8
V 0.1
解得V=0.28,即消耗的甲烷在标准状况下的体积为0.28 L。
CH4 ~ 8e-
22.4 8
V 0.1
解得V=0.28,即消耗的甲烷在标准状况下的体积为0.28 L。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目