题目内容
由短周期前10号元素组成的物质T和X,有如图所示的转化.X不稳定,易分解.为使得下列转化能够成功进行,方框内不可能加入的反应试剂是( )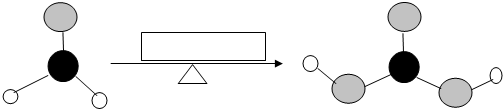

| A.Ag(NH3)2OH | B.溴水 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |
由球棍模型可知,T为HCHO,X不稳定,易分解,则X为H2CO3,则方框内物质为氧化剂,
A.Ag(NH3)2OH为弱氧化剂,Ag(NH3)2OH溶液能氧化HCHO生成碳酸,故A错误;
B.溴水中含有HBrO,HBrO能氧化HCHO生成碳酸,故B错误;
C.KMnO4为强氧化剂,酸性KMnO4溶液能氧化HCHO生成碳酸,故C错误;
D.NaOH溶液与HCHO不反应,即方框内物质一定不为NaOH溶液,故D正确;
故选:D;
A.Ag(NH3)2OH为弱氧化剂,Ag(NH3)2OH溶液能氧化HCHO生成碳酸,故A错误;
B.溴水中含有HBrO,HBrO能氧化HCHO生成碳酸,故B错误;
C.KMnO4为强氧化剂,酸性KMnO4溶液能氧化HCHO生成碳酸,故C错误;
D.NaOH溶液与HCHO不反应,即方框内物质一定不为NaOH溶液,故D正确;
故选:D;

练习册系列答案
相关题目
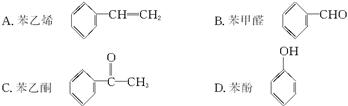
 Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O