题目内容
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
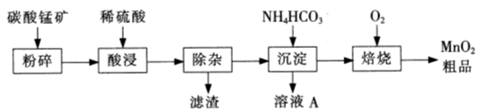
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是 。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+.A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2~、Pb2+后,再加入NaF溶液,除去 。
(3)从溶液A中回收的主要物质是 ,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应韵化学方程式:
。

有关氢氧化物开始沉淀和沉淀完全的pH如下表:

请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是 。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+.A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2~、Pb2+后,再加入NaF溶液,除去 。
(3)从溶液A中回收的主要物质是 ,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应韵化学方程式:
。
(1)增大接触面积,加快反应速率(使反应更充分)
(2)@2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O ②除去Fe3~,A13+ ③Ca2+
(3)(NH4)2SO4
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O (每空2分,本题共12分)
试题分析:化工流程题,(1)将反应物粉碎的作用是增大接触面积,加快反应速率,使反应更充分;(2)pH调到5.2~6.0,其主要目的是除去Fe3~A13+和部分Cu2+;③溶液中除去Fe2+、Fe3+、A13+、Cu2+、Pb2+,但第②加入了Ca2+,再加入NaF溶液,显然是除去Ca2+;(3)流程得到的是碳酸锰沉淀,溶液中主要剩余NH4+和SO42-,故回收的物质是(NH4)2SO4 。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目


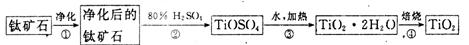
 TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。 394 kJ/mol。
394 kJ/mol。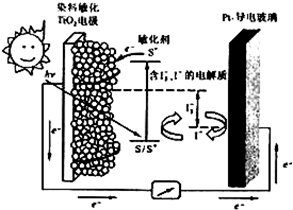
 TiO2/S*(激发态)
TiO2/S*(激发态) TiO2/S+ + e-
TiO2/S+ + e-