题目内容
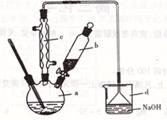
下列有关实验装置进行的相应实验,能达到实验目的的是


| A.用装置①除去Cl2中含有的少量HCl |
| B.用装置②从氯化铁溶液中直接蒸发结晶获得无水氯化铁 |
| C.用装置③制取少量纯净的CO2气体 |
| D.用装置④分离CCl4萃取碘水后已分层的有机层和水层 |
D
试题分析:洗气瓶中的氢氧化钠溶液不仅能与氯化氢反应,而且能与氯气反应,因此不能达到实验目的,应选择饱和食盐水除去氯气中含有的氯化氢,故A错误;氯化铁是强酸弱碱盐,蒸发溶液导致其彻底发生水解反应,生成氢氧化铁沉淀和氯化氢气体,氢氧化铁受热会分解生成氧化铁和水,因此最终产物是氧化铁固体,没有无水氯化铁,故B错误;纯碱的化学式是Na2CO3,稀盐酸的酸性比碳酸强,与纯碱能反应放出二氧化碳气体,但是稀盐酸能挥发出氯化氢气体和水蒸气,因此制取的二氧化碳中混有少量的氯化氢和水,故C错误;四氯化碳与水互不相溶,密度比水重,因此出现分层现象,四氯化碳位于下层,水位于上层,故D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目