题目内容
【题目】在25℃时,将pH=11的NaOH溶液与pH=3的![]() 溶液等体积混合后,下列关系式中正确的是( )。
溶液等体积混合后,下列关系式中正确的是( )。
A.![]()
B.![]()
C.![]()
D.![]()
【答案】B
【解析】
![]() 为弱酸,在25℃时将pH=11的NaOH溶液与pH=3的
为弱酸,在25℃时将pH=11的NaOH溶液与pH=3的![]() 溶液等体积混合时,醋酸过量,溶液呈酸性。
溶液等体积混合时,醋酸过量,溶液呈酸性。
A.设溶液的体积都为1L,![]() 为弱酸,在25℃时将pH=11的
为弱酸,在25℃时将pH=11的![]() 溶液与pH=3的
溶液与pH=3的![]() 溶液等体积混合时,醋酸过量,反应后的溶液中有
溶液等体积混合时,醋酸过量,反应后的溶液中有![]() ,
,![]() ,则
,则![]() ,A错误;
,A错误;
B. 在25℃时将pH=11的![]() 溶液与pH=3的
溶液与pH=3的![]() 溶液等体积混合时,醋酸过量,溶液呈酸性,则有
溶液等体积混合时,醋酸过量,溶液呈酸性,则有![]() ,
,![]() ,反应后溶液为醋酸和醋酸钠的混合溶液,则溶液中
,反应后溶液为醋酸和醋酸钠的混合溶液,则溶液中![]() ,所以有
,所以有![]() ,B正确;
,B正确;
C. 在25℃时将pH=11的![]() 溶液与pH=3的
溶液与pH=3的![]() 溶液等体积混合时,醋酸过量,溶液呈酸性,结合电荷守恒则有
溶液等体积混合时,醋酸过量,溶液呈酸性,结合电荷守恒则有![]() ,C错误;
,C错误;
D. 根据电荷守恒,溶液中存在![]() ,则
,则![]() ,D错误;
,D错误;
故答案选B。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
【题目】(1)提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
括号内为杂质 | 除杂试剂 | 操作 | |
1 | 乙烷(乙烯) | _____ | _____ |
2 | 乙酸乙酯(乙酸) | _____ | _____ |
3 | 苯(苯酚) | _____ | _____ |
4 | 乙醇(水) | _____ | _____ |
(2)以五倍子为原料可制得A,A结构简式如图所示,回答下列问题:
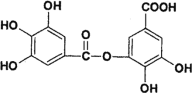
①A的分子式为_______________。
②有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为____________。
③写出A与过量NaOH溶液反应的化学方程式___________。