题目内容
[化学—选修物质结构与性质](15分)
下面的表格是元素周期表的一部分,其中的字母对应不同的元素。(用元素符号回答问题)
|
A |
|
|
|||||||||||||||
|
|
|
|
|
M |
Q |
R |
|
|
|||||||||
|
|
|
E |
|
B |
|
D |
|
||||||||||
|
|
|
|
G |
|
|
|
|
|
|
L |
|
|
|
C |
|
|
|
请回答下列问题:
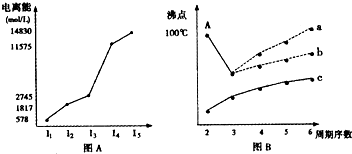
(1)M、Q、R按第一电离能由小到大的顺序为 。
(2)Q元素的氢化物分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”),中心原子呈 杂化方式;
(3)写出L基态原子核外电子排布式 ,L的硫酸盐溶液中加入过量Q的氢化物的水溶液可得深蓝色溶液,请写出该溶液显深蓝色的微粒的化学式 。
(4)已知AMQ分子是直线型分子,则其分子中含有σ键和π键的数目之比为 。
(5)试比较Q、B和C的氢化物沸点高低及热稳定性并说明理由 。
【答案】
(1)C O N (2)三角锥 极性分子 SP3
(3)1S22S22P63S23P63d104S1 〔Cu(NH3)4〕2+ (4)1:1
(5)沸点高低: NH3﹥ASH3﹥PH3结构相似时,相对分子质量越大,分子间作用力越大,因此ASH3沸点高于PH3 ;NH3分子间还存在氢键作用,因此NH3的沸点高于ASH3。
热稳定性:NH3﹥PH3﹥ASH3 因为键能N-H键﹥ P-H键﹥AS-H键或答非金属性N﹥P﹥AS
【解析】

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]