题目内容
【题目】钢铁厂的副产品SO2多用于制硫酸和石膏等。
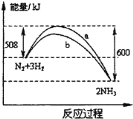
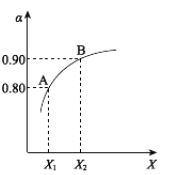
(1)制硫酸最重要的反应是:![]() 。如图表示将2.0molSO2和一定量的O2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,则X(X1、X2)可以代表的物理量是________。
。如图表示将2.0molSO2和一定量的O2置于1L密闭容器中,当其他条件一定时,SO2(g)的平衡转化率α随X的变化关系,则X(X1、X2)可以代表的物理量是________。
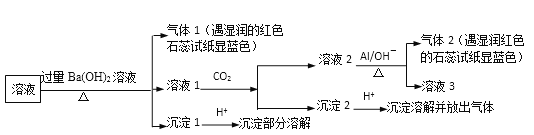
(2)下图表示生产石膏的简单流程,请用平衡移动原理解释向CaCO3悬浊液中通入SO2发生反应的原因_________。
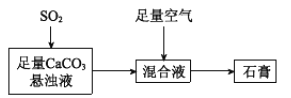
【答案】压强或氧气的量 SO2与水会反应:SO2+ H2O![]() H2SO3;生成的H2SO3会部分电离: H2SO3
H2SO3;生成的H2SO3会部分电离: H2SO3![]() H+ +HSO3-;CaCO3悬浊液中存在CaCO3
H+ +HSO3-;CaCO3悬浊液中存在CaCO3![]() Ca2+(aq)+ CO32-(aq),向CaCO3悬浊液中通入SO2时,CO32-与H+反应,c(CO32-)减小,溶解平衡正向移动
Ca2+(aq)+ CO32-(aq),向CaCO3悬浊液中通入SO2时,CO32-与H+反应,c(CO32-)减小,溶解平衡正向移动
【解析】
(1)依据图中数据可知,随着X量加入SO2(g)的平衡转化率α逐渐增大,反应2SO2(g)+O2(g)![]() 2SO3(g),为气体体积减小的放热反应,加压平衡向正向移动;多种反应物时增大一种反应物浓度可以提高其他反应物转化率,所以对反应2SO2(g)+O2(g)
2SO3(g),为气体体积减小的放热反应,加压平衡向正向移动;多种反应物时增大一种反应物浓度可以提高其他反应物转化率,所以对反应2SO2(g)+O2(g)![]() 2SO3(g),增大氧气的浓度能够提高二氧化硫转化率,图中X可以是压强或氧气的量;
2SO3(g),增大氧气的浓度能够提高二氧化硫转化率,图中X可以是压强或氧气的量;
(2)CaCO3悬浊液中存在CaCO3![]() Ca2+(aq)+ CO32-(aq),向CaCO3悬浊液中通入SO2时,SO2与水会反应:SO2+ H2O
Ca2+(aq)+ CO32-(aq),向CaCO3悬浊液中通入SO2时,SO2与水会反应:SO2+ H2O![]() H2SO3;生成的H2SO3会部分电离: H2SO3
H2SO3;生成的H2SO3会部分电离: H2SO3![]() H+ +HSO3-,CO32与H+反应,c(CO32)减小,溶解平衡正向移动。
H+ +HSO3-,CO32与H+反应,c(CO32)减小,溶解平衡正向移动。

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
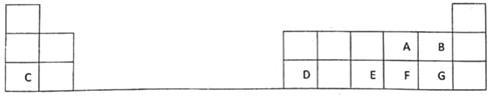
课堂练加测系列答案【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为___,氧化性最弱的简单阳离子是___。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___;制铝时,电解Al2O3而不电解AlCl3的原因是___。
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:___;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式___。
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是___。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:___。