题目内容
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
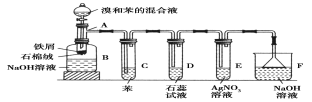
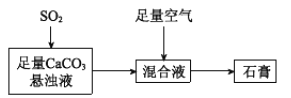
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
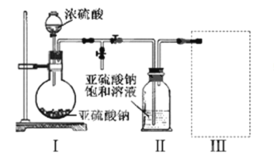
(1)装置I中产生气体的化学方程式为___________________________。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是_______________。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
(4)Na2S2O5溶于水即生成NaHSO3。证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是______________ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是_____________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(6)按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量 (以游离SO2计算)为_______________g·L-1。
(7)在上述实验过程中,若有部分HI被空气氧化,则测得结果_______________ (填“偏高”“偏低”或“不变”)。
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O(或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O) 过滤 d a、e 取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成 0.16 偏低
【解析】
实验一:装置Ⅰ制取二氧化硫,亚硫酸钠与硫酸反应Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O,装置Ⅱ制取Na2S2O5晶体,Na2SO3+SO2=Na2S2O5,装置Ⅲ用于处理尾气吸收未反应的二氧化硫。
(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠或硫酸氢钠、二氧化硫与水;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
实验二:(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,故检验溶液呈酸性即可;
(5)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可。
实验三:(6)①由消耗碘的量,结合SO2+I2+2H2O═H2SO4+2HI计算二氧化硫的质量,进而计算浓度;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小。
(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,或生成硫酸氢钠,反应方程式为:Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离;
(3)a.装置应将导管伸入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故a错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故b错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故c错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故d正确;
故答案为d;
(4)NaHSO3溶液中HSO3的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
(5)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成。
(6)①令100mL葡萄酒中二氧化硫的质量为mg,则:
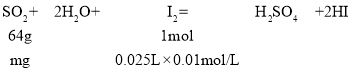
所以,64g:mg=1mol:0.025L×0.01mol/L,解得m=0.016,故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为0.016g×0.1L=0.16g/L;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低。

【题目】某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸溶液在室温下进行反应。实验中所用的草酸为稀溶液,可视为强酸。
(1)将高锰酸钾氧化草酸的离子方程式补充完整。
2MnO4- +_______C2O42- +_____ _____=2Mn2+ +______CO2↑ +_______H2O
(2)该小组进行了实验I,数据如下。
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率______。但分析实验数据,得到的结论是______。
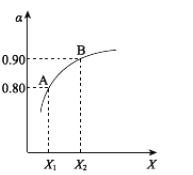
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如下。
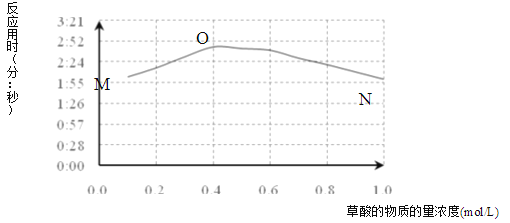
①用文字描述曲线图表达的信息______。
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是______。
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II)。(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物。 |
c | 草酸稳定性较差,加热至185℃可分解。 |
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如下。
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是______。
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因______。为验证该推测还需要补充实验,请对实验方案进行理论设计______。