题目内容
现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2,等的排放,又可以扩大水煤气的广泛用途
(1) 已知:
则反应=_______,(用含
的代数式表示)
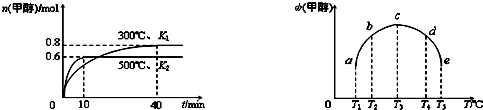
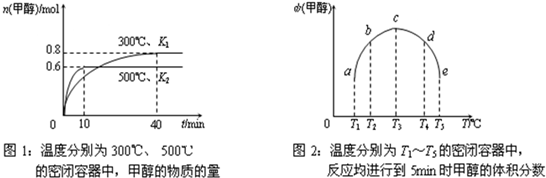
(2) CO和H2在一定条件下合成甲醇的反应为:ΔH3 。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
①该反应的_______O (选填“<”、“>”或“=”)。
②对图2进行分析,从a到c段曲线变化特点看,温度升高甲醇体积分数增高的原因可能是:______________将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有_______
(3)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态K2CO3为电解质。写出该燃料电池负极的电极反应式_______。
(1)(ΔH1-ΔH2)/2
(2)①<
②5min时,反应还未到达平衡,温度越高反应速率越快,甲醇的体积分数越高;
升温或减压
(3)CO+CO32--2e-=2CO2
解析:略

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目

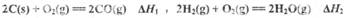
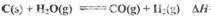 =_______,(用含
=_______,(用含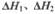 的代数式表示)
的代数式表示)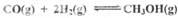 ΔH3 。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
ΔH3 。向容积均为1L的a, b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。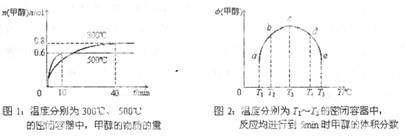
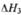 _______O (选填“<”、“>”或“=”)。
_______O (选填“<”、“>”或“=”)。