题目内容
【题目】根据问题填空:
(1)有以下四种物质①22g二氧化碳;②5g氢气;③1.204×1024个氮气分子;④4℃时18g水,质量最大的是_______;常温时体积最大的是________(填序号)。
(2)标准状况下,336L的NH3溶于1L水中,若该溶液的密度为ag/cm3,则其物质的量浓度为____________。
(3)若20g密度为ρg·cm-3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是_______________。
(4)现有下列九种物质:①AgCl ② 铜 ③液态醋酸 ④CO2 ⑤纯硫酸 ⑥Ba(OH)2固体 ⑦C2H5OH ⑧稀硝酸 ⑨熔融NaOH。
①上述属于电解质的是_______________________。
②上述九种物质中有两种物质之间可发生离子反应H++OH-=H2O,该离子反应对应的化学方程式为______________________________。
【答案】③ ② 11.95amol/L 2.5ρmol/L ①③⑤⑥⑨ Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
【解析】
(1)根据m=nM、V=nVm、n=N/NA解答;
(2)根据m=nM、V=nVm、c=n/V结合溶液的密度解答;
(3)根据钙离子的质量计算其物质的量,进而计算硝酸根离子的物质的量,根据m=ρV计算溶液的体积,最后利用c=n/V计算浓度;
(4)溶于水或在熔融状态下能够导电的化合物是电解质;强酸或强酸的酸式盐和可溶性强碱反应生成可溶性盐和水的反应满足H++OH-=H2O。
(1)22g二氧化碳的物质的量为22g÷44g/mol=0.5mol;5g氢气的物质的量是5g÷2g/mol=2.5mol;③1.204×1024个氮气分子的物质的量为![]() =2mol,质量为2mol×28g/mol=56g;18g水物质的量为18g÷18g/mol=1mol,故四种物质中,质量最大的为③。①②③常温下均为气态,根据pV=nRT可知,同温同压时,气体的体积与物质的量成正比,故气体体积最大的是②。水在常温下为气态,1mol水体积约为18mL,远远小于气体的体积。
=2mol,质量为2mol×28g/mol=56g;18g水物质的量为18g÷18g/mol=1mol,故四种物质中,质量最大的为③。①②③常温下均为气态,根据pV=nRT可知,同温同压时,气体的体积与物质的量成正比,故气体体积最大的是②。水在常温下为气态,1mol水体积约为18mL,远远小于气体的体积。
(2)氨气的物质的量为336L÷22.4L/mol=15mol,溶液的总质量为15mol×17g/mol+1000g=1255g,溶液的总体积为![]() ,因此该氨水的物质的量浓度为15mol÷
,因此该氨水的物质的量浓度为15mol÷![]() ≈11.95a mol/L。
≈11.95a mol/L。
(3)硝酸钙溶液的体积为![]() ,1g钙离子的物质的量为1/40 mol,则该硝酸钙溶液中n(NO3﹣)=1/20 mol,则溶液中c(NO3﹣)=1/20 mol÷
,1g钙离子的物质的量为1/40 mol,则该硝酸钙溶液中n(NO3﹣)=1/20 mol,则溶液中c(NO3﹣)=1/20 mol÷![]() =2.5ρmol/L。
=2.5ρmol/L。
(4)①AgCl在熔融状态下能完全电离,故为电解质;
②铜是单质,故既不是电解质也不是非电解质;
③液态醋酸在水溶液中能部分电离,故为电解质;
④CO2在水溶液中或熔融状态下均不能电离出离子,故为非电解质;
⑤H2SO4在水溶液中能完全电离,故为电解质;
⑥Ba(OH)2在水溶液中和熔融状态下能完全电离,故为电解质;
⑦酒精不导电,在溶液中也不导电,属于非电解质;
⑧稀硝酸是混合物,故既不是电解质也不是非电解质;
⑨熔融NaOH中有自由移动的离子,故能导电,故为电解质。
根据分析可知属于电解质的是①③⑤⑥⑨;
②离子方程式H++OH-=H2O表示可溶性强酸或强酸的酸式盐和可溶性强碱发生反应生成可溶性盐和水,故Ba(OH)2和HNO3的反应符合,化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
25 ℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1 L混合溶液,根据上表数据判断,下列说法不正确的是( )
A. 在pH=5的溶液中,Fe3+不能大量存在
B. 混合溶液中c(SO![]() )∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
)∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
C. 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀
D. 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液
【题目】Ⅰ、某校兴趣小组的同学进行“比较过氧化氢在不同条件下的分解”的实验,他们对实验的处理如下表所示:
试管 组别 | 实验处理 | ||
加入体积分数为3%的H2O2溶液(mL) | 温度 | 加入试剂 | |
试管1 | 2 | 常温 | 2滴蒸馏水 |
试管2 | a | 90℃ | 2滴蒸馏水 |
试管3 | 2 | 常温 | 2滴质量分数为3.5%的FeCl3溶液 |
试管4 | 2 | b | 2滴质量分数为20%的肝脏研磨液 |
(1)表格中的a、b应填写的内容分别是 和 。在上表的实验处理中,研究了哪些自变量? 。
(2)表中的哪两组试管对照,可研究生物催化剂与无机催化剂催化效率的差别? 。
(3)在探究温度对酶活性的影响时, (填“能”或“不能”)用过氧化氢为实验材料。
Ⅱ、某校兴趣小组的同学进行了“探究酵母菌细胞呼吸的方式”的实验。请据题分析作答:
现提供若干套(每套均有数个)实验装置如图Ⅰ(a~d)所示:

(1)若要探究的具体问题是:酵母菌是否在有氧、无氧条件下均能产生CO2。根据实验目的选择装置序号,有氧条件下的装置序号为c→b→a→b,则无氧条件下的装置序号为: (用字母和箭头表示)。
(2)装置中c瓶的作用是: ,b瓶中澄清的石灰水还可用溴麝香草酚蓝水溶液代替,则颜色变化为: 。
(3)利用图Ⅱ所示装置(橡皮塞上的弯管为带有红色液滴的刻度玻璃管),探究酵母菌的细胞呼吸类型。想得到实验结论还必须同时设置对照实验,对照实验装置(假设该装置编号为Ⅲ)除用等量清水代替NaOH溶液外,其他设计与装置Ⅱ相同。
请预测与结论相符合的现象,并填写下表:
序号 | 装置中红色液滴的移动现象 | 结论 | |
装置Ⅱ | 装置Ⅲ | ||
1 | 向左移 | 不移动 | 只进行有氧呼吸 |
2 | 不移动 | 向右移 |
|
3 | 向左移 |
| 既进行有氧呼吸,又进行无氧呼吸 |
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

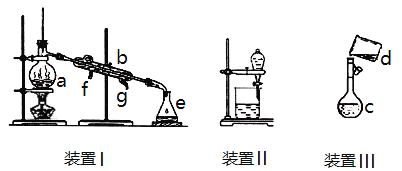
(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。

仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。

(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。

(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。