题目内容
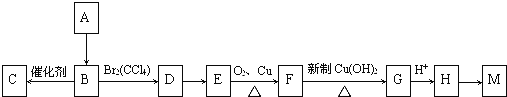
【题目】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用如图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
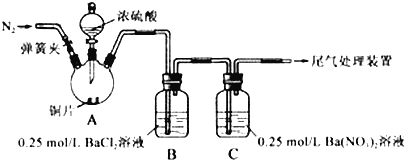
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2, 停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)C中白色沉淀是___,该沉淀的生成表明SO2具有___性。
(2)C中液面上方生成浅棕色气体的化学方程式是___。
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是___;乙在A、B间增加洗气瓶D,D中盛放的试剂是___。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(4)合并(3)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是___。
【答案】BaSO4 还原性 2NO+O2=2NO2 通N2一段时间,排除装置的空气 饱和的NaHSO3溶液 甲:SO42-+Ba2+=BaSO4↓,乙:2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+,白雾的量远多于装置中O2的量 SO2与可溶性钡的强酸盐(硝酸钡除外)不能反应生成BaSO3沉淀
【解析】
A中,铜与浓硫酸反应生成二氧化硫,产生的白雾中可能含有三氧化硫或硫酸,通入到装置B中产生不溶于盐酸的硫酸钡白色沉淀,气体进入装置C与硝酸钡反应生成不溶于盐酸的硫酸钡白色沉淀和NO,NO遇到空气生成浅棕色气体二氧化氮。
(1)A中生成气体SO2,C中的白色沉淀不溶于稀盐酸,说明C中沉淀为是BaSO4,原因是硝酸根离子在酸性条件下具有强氧化性,能将SO2氧化为SO42-,说明SO2具有还原性;
(2)C中发生的反应是3Ba2++3SO2+2NO3-+2H2O=3BaSO4↓+4H++2NO↑,C中液面上方生成浅棕色气体则是硝酸被还原生成的NO遇O2生成了红棕色的NO2之故,化学方程式是2NO+O2=2NO2;
(3)①A中白雾与氯化钡反应能生成BaSO4沉淀,故其可能含有SO3或H2SO4;甲同学为排除装置内空气对实验结果的影响,在Cu与浓硫酸反应前,可先通一会儿N2,排除装置中的空气;A中白雾可能含有SO3或H2SO4,乙同学为除去白雾,可在A、B间增加一个盛放浓硫酸或饱和NaHSO3溶液的洗气瓶;
②在甲、乙两同学的实验中,B中均出现了不溶于稀盐酸的白色沉淀,说明该白色沉淀都是BaSO4,由于甲同学没有排除白雾的干扰,故生成BaSO4沉淀的离子方程式为SO42-+Ba2+=BaSO4↓;乙同学没有排除空气的干扰,其生成BaSO4的离子方程式为2Ba2++2SO2+ O2+2H2O=2BaSO4↓+4H+,白雾的量远多于装置中氧气的量,所以甲中产生大量白色沉淀,乙中产生少量白色沉淀;
(4)合并甲、乙两同学的方案进行实验时,B中无沉淀生成,C中产生白色沉淀,说明SO2与可溶性钡的强酸盐(硝酸钡除外)不能反应生成BaSO3沉淀。