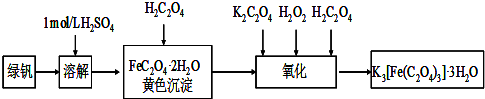
题目内容
绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成分.孔雀石主要含Cu2(OH)2CO3,还含有Fe、Si的化合物(含硅物质不溶于酸).某工厂设计以孔雀石、废铁屑、稀硫酸等为原料制备CuSO4?5H2O与FeSO4?7H2O,流程如图所示.请回答下列问题: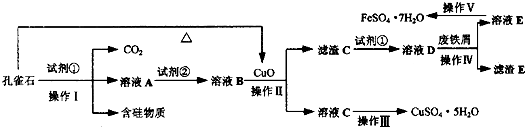
(1)试剂①为
(2)溶液A中的金属阳离子除Cu2+外,还可能含有Fe2+和Fe3+中的一种或两种,检验Fe3+存在的最佳试剂为
①配制溶液.取A溶液10mL,配成250mL,配制溶液所需的仪器除了量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是
②滴定检测.取25mL所配溶液于锥形瓶中,滴加a mol?L-1酸性KMnO4溶液V ml时,溶液恰好变为淡紫色且半分钟内不变色.
③分析计算.A溶液中是否含有Fe2+?
(3)从以下试剂中选择:试剂②为
a.KMnO4
b.(NH4)2S
c.H2O2
d.Cl2
(4)已知滤渣C为Fe(OH)3,试解释向溶液B中加入CuO的作用:
(5)由溶液C获得CuSO4?5H2O,需要经过加热蒸发、
(6)操作V得到的绿矾晶体用少量液体洗涤,该液体可以是
A.冰水
B.蒸馏水
C.80%酒精溶液
D.CCl4.

(1)试剂①为
稀硫酸
稀硫酸
,孔雀石与试剂①反应的主要化学方程式为Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O
Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O
.(2)溶液A中的金属阳离子除Cu2+外,还可能含有Fe2+和Fe3+中的一种或两种,检验Fe3+存在的最佳试剂为
KSCN溶液
KSCN溶液
.为了确定溶液A中是否含有Fe2+并测定其浓度大小,设计以下实验方案:①配制溶液.取A溶液10mL,配成250mL,配制溶液所需的仪器除了量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是
250ml容量瓶
250ml容量瓶
.②滴定检测.取25mL所配溶液于锥形瓶中,滴加a mol?L-1酸性KMnO4溶液V ml时,溶液恰好变为淡紫色且半分钟内不变色.
③分析计算.A溶液中是否含有Fe2+?
含有
含有
(填“含有”或“不含有”,若填“不含有”,则下列空白不用填写),则A溶液中C(Fe2+)为5aVmol/L
5aVmol/L
.(3)从以下试剂中选择:试剂②为
C
C
(填序号),选择原因是既能将Fe2+氧化而又不引入新杂质
既能将Fe2+氧化而又不引入新杂质
.a.KMnO4
b.(NH4)2S
c.H2O2
d.Cl2
(4)已知滤渣C为Fe(OH)3,试解释向溶液B中加入CuO的作用:
除去多余的稀硫酸,调节溶液的PH
除去多余的稀硫酸,调节溶液的PH
.(5)由溶液C获得CuSO4?5H2O,需要经过加热蒸发、
冷却结晶
冷却结晶
、过滤等操作.除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是引流
引流
.(6)操作V得到的绿矾晶体用少量液体洗涤,该液体可以是
C
C
(填序号).A.冰水
B.蒸馏水
C.80%酒精溶液
D.CCl4.
分析:(1)根据反应物、生成物以及反应原理书写反应方程式;
(2)检验Fe3+存在的最佳试剂为KSCN溶液;
①配250mL溶液还需要250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;
(3)能将Fe2+氧化而又不引入新杂质;
(4)加入试剂和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流;
(6)洗涤晶体表面的杂质离子时,既不能使主要物质减少,又能把杂质离子洗去.
(2)检验Fe3+存在的最佳试剂为KSCN溶液;
①配250mL溶液还需要250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;
(3)能将Fe2+氧化而又不引入新杂质;
(4)加入试剂和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流;
(6)洗涤晶体表面的杂质离子时,既不能使主要物质减少,又能把杂质离子洗去.
解答:解:(1)制备的产物为硫酸盐,碱式碳酸铜又不溶于水,试剂①为稀硫酸,反应方程式为:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,
故答案为:稀硫酸;Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;
(2)检验Fe3+选择KSCN溶液,Fe3+遇KSCN溶液变血红色,故答案为:KSCN溶液;
①一般用量筒量取溶液,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.
所以需要的仪器为:托盘天平、药匙、烧杯、筒量(可用、也可不用)、玻璃棒、250ml容量瓶、胶头滴管.
故答案为:250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;由关系式:5Fe2+~MnO4-,可得A溶液中C(Fe2+)为=5aVmol/L,故答案为:含有;5aVmol/L;
(3)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2,故答案为:C;既能将Fe2+氧化而又不引入新杂质;
(4)氧化铜和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质,故答案为:除去多余的稀硫酸,调节溶液的PH;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流,故答案为:冷却结晶;引流;
(6)冰水和蒸馏水均使晶体损耗较多,四氯化碳不能洗去杂质,故选80%酒精溶液,故答案为:C.
故答案为:稀硫酸;Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;
(2)检验Fe3+选择KSCN溶液,Fe3+遇KSCN溶液变血红色,故答案为:KSCN溶液;
①一般用量筒量取溶液,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀.
所以需要的仪器为:托盘天平、药匙、烧杯、筒量(可用、也可不用)、玻璃棒、250ml容量瓶、胶头滴管.
故答案为:250ml容量瓶;
③原溶液被稀释后,Cu2+呈浅蓝色,Fe3+呈浅黄色,两者都不与高锰酸钾溶液反应,所以滴定时参加反应的离子是Fe2+,故A溶液中含有Fe2+;由关系式:5Fe2+~MnO4-,可得A溶液中C(Fe2+)为=5aVmol/L,故答案为:含有;5aVmol/L;
(3)为使Fe2+、Fe3+一块沉淀,要加氧化剂将Fe2+氧化而又不引入新杂质,选H2O2,故答案为:C;既能将Fe2+氧化而又不引入新杂质;
(4)氧化铜和酸反应调节溶液PH使铁离子全部沉淀,加入的试剂不能引入新的杂质,故答案为:除去多余的稀硫酸,调节溶液的PH;
(5)从溶液中要析出晶体,采用冷却结晶法;过滤时要用到玻璃棒引流,故答案为:冷却结晶;引流;
(6)冰水和蒸馏水均使晶体损耗较多,四氯化碳不能洗去杂质,故选80%酒精溶液,故答案为:C.
点评:本题考查金属及其重要化合物的主要性质,题目难度中等,注意(4)中沉淀铁离子时不能引入新的杂质.

练习册系列答案
相关题目