题目内容
18.含有下列各组离子的溶液中,通入过量SO2气体后仍然能大量共存仍然能大量共存的是( )| A. | H+、Na+、NH4+、NO3- | B. | K+、SO32-、Cl-、Na+ | ||
| C. | Ca2+、Cl-、Al3+、H+ | D. | Na+、I-、NH4+、HS- |
分析 根据离子之间不能结合生成沉淀、气体、水等,结合通入过量SO2气体后仍然不反应,则能大量共存,以此来解答.
解答 解:A.通入过量SO2气体后与H+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.通入过量SO2气体后与SO32-反应,不能大量共存,故B错误;
C.该组离子之间不反应,且通入过量SO2气体后不反应,可大量共存,故C正确;
D.通入过量SO2气体后与HS-发生氧化还原反应,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应及氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目
8.心酮胺是治疗冠心病的药物,它具有如下图所示的结构简式.则下列关于心酮胺的叙述不正确的是( )

| A. | 可以发生加成反应 | B. | 在催化剂作用下可以和溴反应 | ||
| C. | 可以发生银镜反应 | D. | 在一定条件下可以发生酯化反应 |
9.有A、B、C、D四种金属,将A与B用导线连接起来,浸入稀硫酸溶液中,B为正极,将A、D分别投入等浓度盐酸中,D比A反应剧烈,将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出,据此判断它们的活动性由强到弱的顺序是( )
| A. | DABC | B. | DCAB | C. | BADC | D. | ABCD |
6.化学实验有助于理解化学知识,形成化学观念.下列实验操作正确的是( )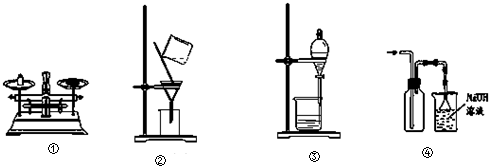

| A. | ①称量药品 | B. | ②过滤 | C. | ③分离乙醇和水 | D. | ④收集氯气 |
3. 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.
(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
依据表中操作,该同学进行实验,观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.为了进一步探究溶液变为深棕色的原因,该同学进行如下实验.
(2)向原新制FeSO4溶液中反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
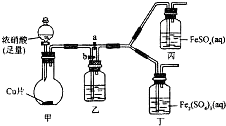
(3)该同学通过查阅资料,认为溶液的红棕色可能是NO2或NO与溶液中Fe 2+或Fe 3+发生反应而得到的,为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
Ⅰ.打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ.为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤Ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到;
(4)该同学重新进行(Ⅰ)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡.
 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.(1)该同学在实验前,依据Fe2+的还原性,填写了下表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2+H2O |
(2)向原新制FeSO4溶液中反应后溶液中均加入KSCN溶液,前者不变红色,后者变红.该现象的结论是Fe2+被硝酸氧化为Fe3+.
(3)该同学通过查阅资料,认为溶液的红棕色可能是NO2或NO与溶液中Fe 2+或Fe 3+发生反应而得到的,为此他利用如图装置(气密性已检验,尾气处理装置略)进行探究.
Ⅰ.打开活塞a,关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化.
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应.
Ⅲ.为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同.
①铜与足量浓硝酸反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙的作用是使NO2转化为NO;
③步骤Ⅱ的目的是排出乙右侧装置中残留的NO2;
④该实验可得出的结论是溶液的深棕色是由Fe2+与NO或NO2作用得到;
(4)该同学重新进行(Ⅰ)中实验,观察到了预期现象,其实验操作是向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡.
7.下列说法不正确的是( )
| A. | CO2,CH4,O2等均是温室效应的气体 | |
| B. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| C. | 磁共振谱可以鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
5.下列离子方程式,书写正确的是( )
| A. | 盐酸与碳酸钡反应 CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 铁与稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ |