题目内容
17.一定条件下反应A(s)+3B(g)?2C(g) 在10L的密闭容器中进行,测得2min内,A的物质的量由20mol减小到8mol,则下列说法中正确的是( )| A. | 继续加入反应物A 2mol,反应速率一定加快 | |
| B. | 温度升高,反应速率一定加快 | |
| C. | 用反应物B表示该反应的反应速率为1.8 mol•L-1•min-1 | |
| D. | 用反应物C表示该反应的反应速率为3.6 mol•L-1•min-1 |
分析 A.A是固体,固体没有浓度而言,所以增大A的量不影响反应速率;
B.升高温度,正逆反应速率都增大;
C.测得2min内,A的物质的量由20mol(560g)减小到8mol(224g),则A参加反应的物质的量=20mol-8mol=12mol,根据方程式知,参加反应的B的物质的量为12mol×3=36mol,B的反应速率=$\frac{\frac{△n}{V}}{△t}$;
D.测得2min内,A的物质的量由20mol(560g)减小到8mol(224g),则A参加反应的物质的量=20mol-8mol=12mol,根据方程式知,生成C的物质的量为12mol×2=24mol,C的反应速率=$\frac{\frac{△n}{V}}{△t}$.
解答 解:A、A是固体,固体没有浓度而言,所以增大A的量不影响反应速率,故A错误;
B、升高温度,正逆反应速率都增大,故B正确;
C、测得2min内,A的物质的量由20mol(560g)减小到8mol(224g),则A参加反应的物质的量=20mol-8mol=12mol,根据方程式知,参加反应的B的物质的量为12mol×3=36mol,B的反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{36mol}{10L}}{2min}$=1.8mol•L-1•min-1,故C正确;
D、测得2min内,A的物质的量由20mol(560g)减小到8mol(224g),则A参加反应的物质的量=20mol-8mol=12mol,根据方程式知,生成C的物质的量为12mol×2=24mol,C的反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{24mol}{10L}}{2min}$=1.2mol/(L•min),故D错误;
故选BC.
点评 本题考查化学反应速率的有关计算,明确反应速率与计量数的关系即可解答,侧重考查分析计算能力,易错选项是A,注意增大固体和纯液体的量不影响反应速率.

| A. | 漂白粉溶液在空气中生效:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓ | |
| B. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- | |
| C. | 氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ | |
| D. | 0.01 mol•L-1NH4Al(SO4)2溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O |
| A. | 气体CO2(HCl):通过饱和NaHCO3溶液 | B. | 固体Na2CO3(NaHCO3):加热 | ||
| C. | 气体Cl2(HCl):通过NaOH溶液 | D. | FeCl3溶液(FeCl2):通入Cl2 |
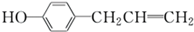 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )| A. | 1 mol胡椒酚最多可与4 mol氢气发生反应 | |
| B. | 1 mol胡椒酚最多可与4 mol溴发生反应 | |
| C. | 胡椒酚可与甲醛发生反应,生成聚合物 | |
| D. | 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
| A. | 溶量瓶未干燥 | |
| B. | 溶解搅拌时有液体漏出 | |
| C. | 定容时俯视容量瓶刻度线 | |
| D. | 摇匀后见液面低于刻度线,再加水至刻度线 |
| A. | HCO3- | B. | Cl- | C. | SO32- | D. | SO42- |
| A. |  | B. | 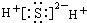 | ||
| C. |  | D. | 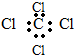 |
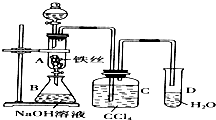 某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭).(已知此反应属于放热反应;苯和液溴都易挥发)
某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭).(已知此反应属于放热反应;苯和液溴都易挥发) ;CaCl2
;CaCl2 .
.