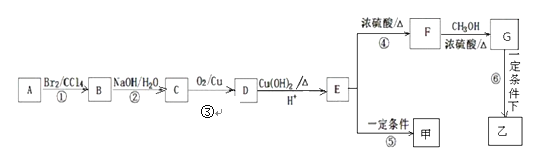
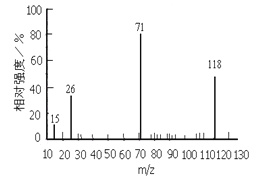
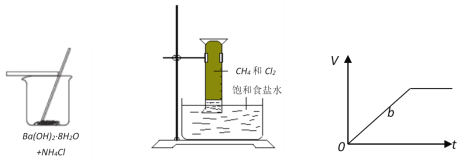
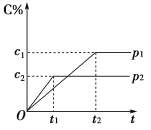
题目内容
【题目】某学习小组为研究电化学原理,设计如图装置。请回答下列问题:
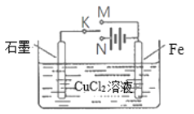
(1)若K与M、N均断开,发生的离子反应为____________________。
(2)若K与M相连、与N断开,石墨为_________(填电极名称)。
(3)若K与N相连、与M断开,石墨电极处的现象为____________________。
(4)若将CuCl2溶液换成精制饱和食盐水,仍保持K与N相连、与M断开,此时装置中发生的离子反应方程式为_______________________________。若此反应过程中转移1mol电子,理论上共产生标准状况下气体__________________L。
【答案】Fe + Cu2+ = Fe2+ + Cu 正极 有黄绿色气体产生 2Cl-+2H2O ![]() Cl2↑+H2↑+2OH- 22.4
Cl2↑+H2↑+2OH- 22.4
【解析】
(1)铁比铜或活泼,K与M、N均断开时,铁可与硫酸铜溶液发生置换反应;
(2)K与M相连时,为铜铁原电池反应,铁为负极,石墨为正极;
(3)K与N相连时,石墨为阳极,铁为阴极,以此解答.
(2)根据方程式,每转移1mol电子,即产生 1mol气体。
(1)铁比铜活泼,K与M、N均断开时,铁可与硫酸铜溶液发生置换反应,发生的离子反应为Fe + Cu2+ = Fe2+ + Cu 。
(2)若K与M相连、与N断开,为铜铁原电池反应,铁为负极,石墨为正极。
(3)若K与N相连、与M断开,石墨为阳极,发生2Cl--2e-=Cl2,石墨电极处的现象为有黄绿色气体产生。
(4)若将CuCl2溶液换成精制饱和食盐水,仍保持K与N相连、与M断开,石墨为阳极,发生2Cl--2e-=Cl2↑,铁为阴极,发生2H2O+2e-=2OH-+H2↑,此时装置中发生的离子反应方程式为2Cl-+2H2O ![]() Cl2↑+H2↑+2OH- 。根据方程式,每转移1mol电子,即产生 1mol气体,现此反应过程中转移1mol电子,理论上共产生标准状况下气体22.4L。
Cl2↑+H2↑+2OH- 。根据方程式,每转移1mol电子,即产生 1mol气体,现此反应过程中转移1mol电子,理论上共产生标准状况下气体22.4L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案