题目内容
pH=11的NaOH溶液和pH=3的醋酸溶液以等体积混合后,所得溶液中c(Na+)和c(CH3COO-)?的正确关系是( )
| A、c(Na+)>c(CH3COO-)? |
| B、c(Na+)=c(CH3COO-)? |
| C、c(Na+)<c(CH3COO-)? |
| D、不能确定 |
考点:酸碱混合时的定性判断及有关ph的计算,离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:氢氧化钠为强电解质,pH=11的NaOH溶液中氢氧化钠的浓度为0.001mol/L;醋酸为弱电解质,溶液中只能部分电离出氢离子,pH=3的醋酸溶液中醋酸的浓度大于0.001mol/L,两溶液等体积混合后,醋酸过量,溶液显示酸性,即c(H+)>c(OH-),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知c(Na+)<c(CH3COO-).
解答:
解:NaOH属于强碱,pH=11的NaOH溶液中氢氧化钠的浓度为:c(NaOH)=c(OH-)=
=0.001mol/L,
醋酸为弱酸,pH=3的醋酸溶液中氢离子浓度为:c(H+)=0.001mol/L,醋酸的浓度c(CH3COOH)>c(H+)=0.001mol/L,
两溶液等体积混合后,醋酸过量,溶液显示酸性,则:c(H+)>c(OH-),
根据反应后的溶液中电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
反应后的溶液中一定满足:c(Na+)<c(CH3COO-),
故选C.
| 1×10-14 |
| 1×10-11 |
醋酸为弱酸,pH=3的醋酸溶液中氢离子浓度为:c(H+)=0.001mol/L,醋酸的浓度c(CH3COOH)>c(H+)=0.001mol/L,
两溶液等体积混合后,醋酸过量,溶液显示酸性,则:c(H+)>c(OH-),
根据反应后的溶液中电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
反应后的溶液中一定满足:c(Na+)<c(CH3COO-),
故选C.
点评:本题考查了酸碱混合后定性判断及溶液中离子浓度定性比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的计算方法,能够根据溶液的酸碱性、电荷守恒、物料守恒比较溶液中各离子之间浓度大小.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
下列离子方程式书写正确的是( )
| A、金属钠和水的反应:Na+2H2O═H2↑+Na++OH- |
| B、Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+═Al3++3H2O |
| C、FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- |
| D、醋酸溶液中滴加氢氧化钠:H++OH-═H2O |
设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
| A、-OH与OH-含有的电子数相同 |
| B、1mol C3H8分子中含有的共价键数目为11NA |
| C、1mol碳正离子CH5+所含的电子数为10NA |
| D、标准状况下,22.4L CCl4中含有NA个碳原子 |
类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论正确的是( )
| A、由“Cl2+H2O═HCl+HClO”可推出“F2+H2O═HF+HFO” |
| B、HCl的水溶液是强酸,推出HF的水溶液也是强酸 |
| C、由“2Fe+3Cl2═2FeCl3”可推出“2Fe+3I2═2FeI3” |
| D、Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
在2升的密闭容器中,发生以下反应:2A(g)+B(g)?2C(g)+D(g),若最初加入的A和B都是2mol,在前10秒钟A的平均反应速度为0.04mol/(L?s),则10秒钟时,容器中B的物质的量是( )
| A、0.8 mol |
| B、1.2 mol |
| C、1.6 mol |
| D、1.8 mol |
下列说法不正确的是( )
| A、苯和浓硫酸在70~80℃时发生磺化反应 | ||
| B、芳香烃是分子组成符合CnH2n-6(n≥6)的一类物质 | ||
| C、甲苯可以和浓硝酸与浓硫酸的混合物发生硝化反应 | ||
D、等质量的烃(CXHY)耗氧量取决于
|
在下列变化过程中,不涉及化学反应的是( )
| A、金属冶炼 | B、冰雪融化 |
| C、葡萄糖氧化 | D、木柴燃烧 |
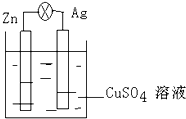 如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为
如图所示,在银锌原电池中,以硫酸铜为电解质溶液,锌为