题目内容
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
A
试题分析:①无论醋酸溶液与NaOH溶液怎样混合,电荷守恒有c (Na+) + c(H+)=c(OH) + c(CH3COO-),说法正确;②对已建立化学平衡的某可逆反应,当加入反应物使化学平衡向正反应方向移动时,生成物的百分含量可能减少,说法不正确;③同物质的量浓度的CaCl2和NaCl溶液中,c(Cl-)前者是后者的二倍,AgCl在NaCl溶液中的溶解度更大,说法错误;④常温下,已知醋酸电离平衡常数为Ka、醋酸根水解平衡常数为Kh、水的离子积为Kw,根据醋酸根的水解CH3COO-+H2O
 CH3COOH+OH-,有:Kh=
CH3COOH+OH-,有:Kh= =
=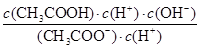 =
=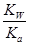 ,故Ka·Kh=Kw;⑤电解精炼铜时,由于粗铜中的较Cu活泼的金属变为金属阳离子进入电解质溶液中,铜离子浓度减小,说法错误。
,故Ka·Kh=Kw;⑤电解精炼铜时,由于粗铜中的较Cu活泼的金属变为金属阳离子进入电解质溶液中,铜离子浓度减小,说法错误。 
练习册系列答案
相关题目
 CH3OH(g) ΔH
CH3OH(g) ΔH
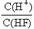 的值始终保持增大
的值始终保持增大