题目内容
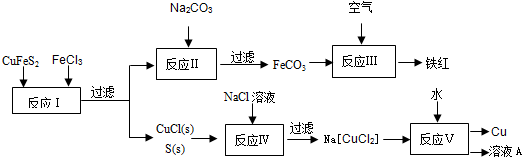
黄铜矿(CuFeS2)是制取铜的主要原料,还可制备硫及铁的化合物.(1)冶炼铜的反应为:
8CuFeS2+21O2
| ||
若CuFeS2中Cu、Fe的化合价均为+2,反应中被氧化的元素有
(2)上述冶炼过程中产生大量的SO2,下列关于SO2的说法中正确的是
a.可处理后用于消毒杀菌
b.可排放到空气中消灭害虫
c.可处理后用于漂白织物
d.可用KMnO4溶液吸收制浓硫酸
(3)过二硫酸钾(K2S2O8)具有强氧化性,经少量K2S2O8处理过的KI溶液遇淀粉变蓝色,写出K2S2O与KI溶液反应的离子方程式:
(4)用冶炼铜反应的固体产物配制FeCl2溶液,首先用
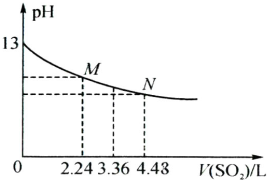
(5)将足量的SO2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随SO2体积(已换算成标准状况,不考虑溶液体积变化)的变化曲线如图所示:
①NaOH溶液的物质的量浓度为
②n(SO2):n(NaOH)=1:2,反应对应M点的纵坐标
③N点溶液中含有的阴离子除OH-外,还有
分析:(1)在氧化还原反应中,化合价升高的元素被氧化;
(2)根据二氧化硫的性质和作用来回答;
(3)过二硫酸钾(K2S2O8)具有强氧化性,碘离子具有还原性,根据氧化还原反应知识来回答;
(4)FeO和Fe2O3都能和盐酸反应生成对应的盐,三价铁可以和金属铁反应生成亚铁离子,三价铁离子遇到硫氰酸钾显示红色;
(5)①根据氢氧化钠溶液的pH计算溶液的浓度;
②当n(SO2):n(NaOH)=1:2时,二者发生反应生成亚硫酸钠和水,亚硫酸钠会发生水解反应;
③根据二氧化硫的量以及氢氧化钠的量之间的关系来判断化学反应后的产物.
(2)根据二氧化硫的性质和作用来回答;
(3)过二硫酸钾(K2S2O8)具有强氧化性,碘离子具有还原性,根据氧化还原反应知识来回答;
(4)FeO和Fe2O3都能和盐酸反应生成对应的盐,三价铁可以和金属铁反应生成亚铁离子,三价铁离子遇到硫氰酸钾显示红色;
(5)①根据氢氧化钠溶液的pH计算溶液的浓度;
②当n(SO2):n(NaOH)=1:2时,二者发生反应生成亚硫酸钠和水,亚硫酸钠会发生水解反应;
③根据二氧化硫的量以及氢氧化钠的量之间的关系来判断化学反应后的产物.
解答:解:(1)在氧化还原反应中,化合价升高的元素Fe、S,被氧化,故答案为:Fe、S;
(2)a.二氧化硫处理后用于消毒杀菌,故a正确;
b.二氧化硫有毒,不可排放到空气中,故b错误;
c.二氧化硫具有漂白性,可处理后用于漂白织物,故c正确;
d.二氧化硫具有还原性,可被KMnO4溶液氧化,故d错误.
故选ac;
(3)过二硫酸钾(K2S2O8)具有强氧化性,碘离子具有还原性,二者发生氧化还原反应:S2O82-+2I-=2SO42-+I2,故答案为:S2O82-+2I-=2SO42-+I2;
(4)FeO和Fe2O3都能和盐酸反应生成对应的盐氯化亚铁、氯化铁,配置亚铁盐,为防止被氧化,可以加入金属单质铁,三价铁可以和金属铁反应生成亚铁离子,并且三价铁离子遇到硫氰酸钾显示红色,故答案为:稀盐酸;铁粉;KSCN溶液;变红;
(5)①根据 二氧化硫之前,氢氧化钠溶液的pH是13,所以氢氧化钠溶液的浓度是0.1mol/L,故答案为:0.1mol/L;
②当n(SO2):n(NaOH)=1:2时,二者发生反应生成亚硫酸钠和水,即SO2+2NaOH=Na2SO3+H2O,生成的亚硫酸钠中亚硫酸根离子会发生水解反应,溶液显示碱性,
故答案为:>;
③在M点,二氧化硫的物质的量是0.1mol,二氧化硫和氢氧化钠的物质的量之比是1:2,所以氢氧化钠的物质的量是0.2mol,故N点二氧化硫和氢氧化钠的物质的量之比是0.2mol:0.2ml=1:1,即N点溶液是亚 硫酸氢钠溶液,亚硫酸氢根离子可以电离出氢离子和亚硫酸根离子,此时溶液中含有的阴离子除OH-外,还有SO32-和HSO3-,
故答案为:SO32-和HSO3-.
(2)a.二氧化硫处理后用于消毒杀菌,故a正确;
b.二氧化硫有毒,不可排放到空气中,故b错误;
c.二氧化硫具有漂白性,可处理后用于漂白织物,故c正确;
d.二氧化硫具有还原性,可被KMnO4溶液氧化,故d错误.
故选ac;
(3)过二硫酸钾(K2S2O8)具有强氧化性,碘离子具有还原性,二者发生氧化还原反应:S2O82-+2I-=2SO42-+I2,故答案为:S2O82-+2I-=2SO42-+I2;
(4)FeO和Fe2O3都能和盐酸反应生成对应的盐氯化亚铁、氯化铁,配置亚铁盐,为防止被氧化,可以加入金属单质铁,三价铁可以和金属铁反应生成亚铁离子,并且三价铁离子遇到硫氰酸钾显示红色,故答案为:稀盐酸;铁粉;KSCN溶液;变红;
(5)①根据 二氧化硫之前,氢氧化钠溶液的pH是13,所以氢氧化钠溶液的浓度是0.1mol/L,故答案为:0.1mol/L;
②当n(SO2):n(NaOH)=1:2时,二者发生反应生成亚硫酸钠和水,即SO2+2NaOH=Na2SO3+H2O,生成的亚硫酸钠中亚硫酸根离子会发生水解反应,溶液显示碱性,
故答案为:>;
③在M点,二氧化硫的物质的量是0.1mol,二氧化硫和氢氧化钠的物质的量之比是1:2,所以氢氧化钠的物质的量是0.2mol,故N点二氧化硫和氢氧化钠的物质的量之比是0.2mol:0.2ml=1:1,即N点溶液是亚 硫酸氢钠溶液,亚硫酸氢根离子可以电离出氢离子和亚硫酸根离子,此时溶液中含有的阴离子除OH-外,还有SO32-和HSO3-,
故答案为:SO32-和HSO3-.
点评:本题综合考查学生氧化还原反应知识以及元素及化合物知识,属于综合知识的考查,难度大.

练习册系列答案
相关题目
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜时发生如下反应:2Cu2O+Cu2S
6Cu+SO2↑.
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol?L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3) c(SO32-)(填“>”、“=”或“<”),原因是 .
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中 作阴极.
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
在25℃下,向浓度均为0.1mol?L-1的FeCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 .
| ||
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol?L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3)
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×-20 | 4.0×10-38 |