题目内容
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
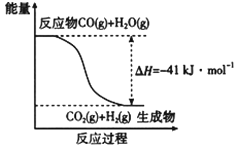
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示,反应的热化学方程式为____________________________________________。
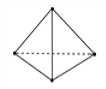
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,1mol N4生成N2的ΔH=_________ kJ·mol-1
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。298K时,已知:
①C(s,石墨)+O2(g)![]() CO2(g) ΔH1=a kJ·mol-1
CO2(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=b kJ·mol-1
2H2O(l) ΔH2=b kJ·mol-1
③2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
则反应:2C(s,石墨)+H2(g)![]() C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是____________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法比较
【答案】CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ/mol-882(2a+b/2-c/2)kJ/molB
【解析】
(1)根据图像可知反应热=-41kJ/mol,所以反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;故答案为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1;
(2)由题意知,N≡N的键能为942kJ/mol,N-N键的键能为167kJ/mol,1molN4生成N2(g)的反应为:N4(g)=2N2(g),反应热等于反应物的总键能减去生成物的总键能,所以反应热△H=6×167kJ/mol -2×942kJ/mol= -882kJ/mol,故答案为:-882;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=akJmol-1;②2H2(g)+O2(g)=2H2O (l)△H2=bkJmol-1;③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=ckJmol-1;2C(s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×1/2-③×1/2得到,所以反应焓变△H=2×a+b×1/2-c×1/2=(2a+b/2-c/2)kJ/mol;故答案为:(2a+b/2-c/2)kJ/mol;
(4)4Al(s)+3O2(g)═2Al2O3(s)△H1 ① 4Fe(s)+3O2(g)═2Fe2O3(s)△H2 ② 由盖斯定律①-②,得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1 -△H2,铝热反应为放热反应,即△H1 -△H2<0,所以△H1<△H2;故答案为:B。

 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|



