题目内容
7.氮、磷及其化合物在科研及生产中均有着重要的应用.(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式:Fe+4H++NO3-=Fe3++NO↑+2H2O.

(2)LiFePO4是一种新型动力锂电池的电极材料.
①图1为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式:Li++FePO4+e-=LiFePO4.
②将LiOH、FePO4•2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4.焙烧过程中N2的作用是防止生成的Fe2+在空气中重新被氧化;实验室中以Fe3+为原料制得的FePO4•2H2O有时显红褐色,FePO4•2H2O中混有的杂质可能为Fe(OH)3.
(3)磷及部分重要化合物的相互转化如图2所示.
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是做还原剂.
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为0.05mol.
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有CaHPO4、Ca(H2PO4)2.
分析 (1)铁和过量稀硝酸反应生成硝酸铁、一氧化氮和水;
(2)①在原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据得失电子确定正负极,根据反应物、生成物书写电极反应式.
②制备锂电池正极材料LiFePO4.需要防止亚铁被氧化分析判断;红褐色可能是晶体在下层了氢氧化铁胶体;
(3)①依据发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,判断CO的作用;
②依据氧化还原反应中铜元素、磷元素化合价变化计算;
③磷酸为三元酸与氢氧化钙反应,依据磷酸与氢氧化钙量不同,得到的产物可能是:Ca3(PO4)2、CaHPO4、Ca(H2PO4)2.
解答 解:(1)铁和过量稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)①放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4,
故答案为:Li++FePO4+e-=LiFePO4;
②制备锂电池正极材料LiFePO4.需要防止亚铁被氧化分析,焙烧过程中N2的作用是防止生成的Fe2+在空气中重新被氧化;红褐色可能是晶体在下层了氢氧化铁胶体;
故答案为:防止生成的Fe2+在空气中重新被氧化,Fe(OH)3(或氢氧化铁);
(3)①步骤Ⅰ为白磷的工业生产方法之一,发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,反应中C中的碳化合价升高,做还原剂;
故答案为:做还原剂;
②Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,则由电子守恒可知,有1 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为n则:n×4(5-0)=1mol×(2-1),解得n=$\frac{1}{20}$mol;=0.05mol
故答案为:0.05mol
③磷酸为三元酸与氢氧化钙反应,依据磷酸与氢氧化钙量不同,得到的产物可能是:Ca3(PO4)2、CaHPO4、Ca(H2PO4)2;
故答案为:CaHPO4、Ca(H2PO4)2.
点评 本题依据N、P及其化合物的转化为情境考查了氧化还原反应的概念及有关计算,原电池原理分析应用,抓住氧化还原反应得失电子守恒是解题关键,题目难度较大.

 阅读快车系列答案
阅读快车系列答案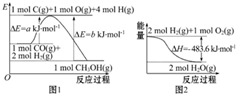
| A. | 根据图1可知合成甲醇的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 图2表示2 mol H2(g)所具有的能量比2 mol气态水所具有的能量多483.6 kJ | |
| C. | 1 mol NaOH分别和1 mol 稀硫酸、1 mol浓硫酸反应,前者的△H比后者的△H大 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
| A. | 0.20mol | B. | 0.21mol | C. | 0.22mol | D. | 0.23mol |
| A. | baXn-中含有的中子数为a+b | B. | baXn-中含有的电子数为a-n | ||
| C. | X原子的质量约为(b/NA)g | D. | 此元素的相对原子质量为b |
| A. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 澄清石灰水中滴加少量NaHCO3:Ca2++2OH++2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
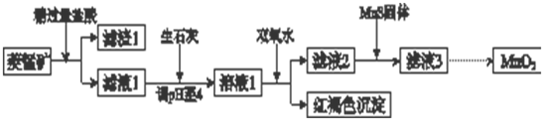
已知:
生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:
□Mn2++□ClO3-+□4H2O=□Cl2↑;+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
| A. | 甲烷分子中的C-H键完全相同 | |
| B. | 甲烷分子的结构具有对称性 | |
| C. | 甲烷分子的二氯代物只有一种结构 | |
| D. | 分子组成为CHCl3的物质具有固定的熔、沸点 |
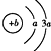 ,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:
,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题: