题目内容
4.下列关系式错误的是( )| A. | CO2的水溶液:c(H+)>c(HCO3-)>2c(CO32-) | |
| B. | 等浓度的HCN溶液与Na0H溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+)>c(CN-)>c(OH-)>c(H+) | |
| C. | 0.4mol•L-1某一元酸HA溶液和0.2mol•L-1Na0H溶液等体积混合的溶液中:2c(OH-)+c(A-)=2c(H+)+c(HA) | |
| D. | 两种弱酸HX和HY混合后,溶液中的c(H+)为(Ka为电离平衡常数):c(H+)=$\frac{{K}_{a}(HX)•c(HX)}{c({X}^{-})}$+$\frac{{K}_{a}(HY)•c(HY)}{c({Y}^{-})}$+c(OH-) |
分析 A.碳酸为二元弱酸,主要以第一步电离为主,且氢离子来自还来自水的电离,则c(H+)>c(HCO3-)>2c(CO32-);
B.溶液的pH>7,则c(OH-)>c(H+),根据电荷守恒判断各离子浓度大小;
C.反应后溶质为等浓度的HA和NaA,根据电荷守恒和物料守恒分析;
D.混合液中c(H+)=$\frac{{K}_{a}(HX)•c(HX)}{c({X}^{-})}$=$\frac{{K}_{a}(HY)•c(HY)}{c({Y}^{-})}$,据此进行判断.
解答 解:A.CO2的水溶液中,碳酸部分电离出氢离子,溶液呈酸性,由于氢离子还来自水的电离、HCO3-的电离,则c(H+)>c(HCO3-),由于第二步电离极弱,则c(HCO3-)>>c(CO32-),所以该溶液中离子浓度大小为:c(H+)>c(HCO3-)>2c(CO32-),故A正确;
B.等浓度的HCN溶液与Na0H溶液等体积混合,所得溶液pH>7,则c(OH-)>c(H+),根据电荷守恒可得:c(Na+)>c(CN-),则溶液中溶液中离子浓度大小为:c(Na+)>c(CN-)>c(OH-)>c(H+),故B正确;
C.0.4mol•L-1某一元酸HA溶液和0.2mol•L-1Na0H溶液等体积混合,反应后溶质浓度为0.1mol/L的NaA和0.1mol/L的HA,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(A-),根据物料守恒得:2c(Na+)=c(A-)+c(HA),二者结合可得:2c(OH-)+c(A-)=2c(H+)+c(HA),故C正确;
D.两种弱酸HX和HY混合后,根据二者的电离平衡常数可知溶液中的c(H+)为(Ka为电离平衡常数):c(H+)=$\frac{{K}_{a}(HX)•c(HX)}{c({X}^{-})}$=$\frac{{K}_{a}(HY)•c(HY)}{c({Y}^{-})}$,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,要求学生能够根据物料守恒、电荷守恒及盐的水解原理正确判断离子浓度大小.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | C4H10的一种同分异构体只能生成一种一氯代物 | |
| B. | CH3-CH=CH-C≡C-CF3分子结构中6个碳原子可能都在一条直线上 | |
| C. | 某物质的名称为:2-乙基-2-丁烯 | |
| D. | 2-丁烯存在顺反异构体 |
| A. | Ba(NO3)2溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | CH3COOH溶液 |
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
(2)1100℃时化学平衡常数K=$\frac{4}{9}$,该反应为放热反应(填“吸热”和“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向正反应方向移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
| A. | 等物质的量C3H8与C3H8O完全燃烧时耗氧量相同 | |
| B. | 某气态有机物的密度为ρ,其相对分子质量为22.4ρ | |
| C. | 硬脂酸常温下呈固态,难溶于水,酸性比醋酸弱 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 |
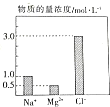 在0.2L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示.
在0.2L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示.