题目内容
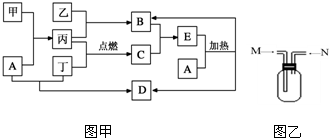
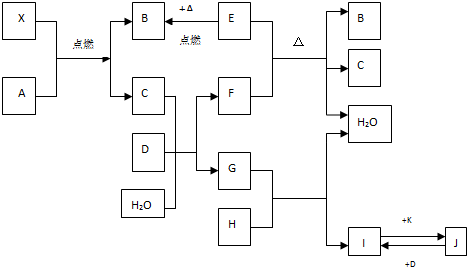
下列框图甲所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质.气体B与气体C相遇产生大量的白烟生成E,A是强碱,D的焰色为紫色(部分反应物和生成物及水已略去).
请回答下列问题
(1)写出工业制备B的化学方程式______;
(2)写出常温下,A与丁反应的离子方程式______;
(3)图乙装置为用排空气法收集气体的实验装置
Ⅰ.当从M端通入气体时,可收集的气体有______;
Ⅱ.当从N端通入气体时,可收集的气体有______;(填数字编号)
①气体乙②气体丙③气体丁④气体B⑤气体C
(4)E中所含阳离子的检验方法为(包括实验步骤、现象及结论)______;
(5)A中所含阳离子的检验方法为(包括实验步骤、现象及结论)______.

请回答下列问题
(1)写出工业制备B的化学方程式______;
(2)写出常温下,A与丁反应的离子方程式______;
(3)图乙装置为用排空气法收集气体的实验装置
Ⅰ.当从M端通入气体时,可收集的气体有______;
Ⅱ.当从N端通入气体时,可收集的气体有______;(填数字编号)
①气体乙②气体丙③气体丁④气体B⑤气体C
(4)E中所含阳离子的检验方法为(包括实验步骤、现象及结论)______;
(5)A中所含阳离子的检验方法为(包括实验步骤、现象及结论)______.
乙、丙、丁为单质,一定条件下乙与B反应得到B,丙、丁在点燃条件下反应得到C,且B与C相遇生成大量白烟生成E,可知B为NH3,C为HCl,则丙为H2,乙为N2,丁应为Cl2,E为NH4Cl,NH4Cl与强碱A反应生成NH3与D,且D的焰色为紫色,含有K元素,故A为KOH、D为KCl,甲是日常生活中常见的金属,能与KOH反应生成氢气,则E为Al,
(1)工业制备氨气的化学方程式为:N2+3H2
2NH3,
故答案为:N2+3H2
2NH3;
(2)常温下,氯气与KOH反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)图乙装置为用排空气法收集气体的实验装置,
Ⅰ.当从M端通入气体时,应收集密度比空气大的气体,故可以收集C(HCl)、丁(Cl2);
Ⅱ.当从N端通入气体时,应收集密度比空气下的气体,故可收集的气体有:B(NH3)、丙(H2),
N2密度与空气相差不大,不易采取排空气法收集,
故答案为:Ⅰ.③⑤;Ⅱ.②④;
(4)E中所含阳离子为NH4+,检验方法为:取少许与试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+,
故答案为:取少许与试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+;
(5)A中所含阳离子为K+,检验方法为:用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+,
故答案为:用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+.
(1)工业制备氨气的化学方程式为:N2+3H2
| ||
| 高温高压 |
故答案为:N2+3H2
| ||
| 高温高压 |
(2)常温下,氯气与KOH反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)图乙装置为用排空气法收集气体的实验装置,
Ⅰ.当从M端通入气体时,应收集密度比空气大的气体,故可以收集C(HCl)、丁(Cl2);
Ⅱ.当从N端通入气体时,应收集密度比空气下的气体,故可收集的气体有:B(NH3)、丙(H2),
N2密度与空气相差不大,不易采取排空气法收集,
故答案为:Ⅰ.③⑤;Ⅱ.②④;
(4)E中所含阳离子为NH4+,检验方法为:取少许与试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+,
故答案为:取少许与试管中,加入NaOH溶液,加热,用湿润的红色石蕊试纸靠近试管口,试纸变蓝,证明含有NH4+;
(5)A中所含阳离子为K+,检验方法为:用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+,
故答案为:用洁净的铂丝蘸取A溶液,在无色火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,证明含有K+.

练习册系列答案
相关题目
 请按要求回答下列问题:
请按要求回答下列问题: