题目内容
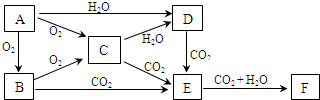
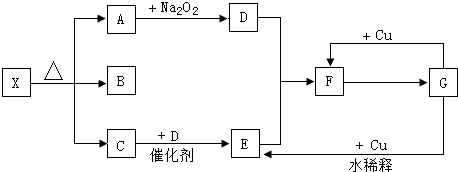
如图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,B为液体,C能使湿润的红色石蕊试纸变蓝,A、B、C的物质的量之比为1:1:1.
(1)写出下列各物质的化学式:X:______;B:______;F:______.
(2)写出A→D变化的反应方程式:______,若有1molNa2O2完全反应,则转移的电子数为______mol.
(3)写出G→E变化的化学方程式,并用双线桥标出电子转移的方向和数目:______.
(4)将等物质的量的E、F混合气通入NaOH溶液中,恰好被吸收,生成一种钠盐,试写出该反应的化学方程式:______.
(5)实验室里,检验X中阳离子的方法是______.
(6)120℃时,X物质完全分解的产物的平均相对分子量是______.(保留一位小数)

(1)写出下列各物质的化学式:X:______;B:______;F:______.
(2)写出A→D变化的反应方程式:______,若有1molNa2O2完全反应,则转移的电子数为______mol.
(3)写出G→E变化的化学方程式,并用双线桥标出电子转移的方向和数目:______.
(4)将等物质的量的E、F混合气通入NaOH溶液中,恰好被吸收,生成一种钠盐,试写出该反应的化学方程式:______.
(5)实验室里,检验X中阳离子的方法是______.
(6)120℃时,X物质完全分解的产物的平均相对分子量是______.(保留一位小数)
C能使湿润的红色石蕊试纸变蓝,应为NH3,A和过氧化钠反应生成D为气体,且A是无色气体,所以A应为CO2,D为O2,氨气和氧气在催化剂条件下加热生成NO和水,E能和氧气反应,所以E是NO,F为NO2,F和B反应生成G,G和铜反应生成二氧化氮,G为HNO3,B为液体,应为H2O,A、B、C的物质的量之比为1:1:1,则X为NH4HCO3,
(1)由以上分析可知,X为NH4HCO3,B为H2O,F为NO2,
故答案为:NH4HCO3;H2O;NO2;
(2)A→D为Na2O2和CO2的反应,方程式为2CO2+2Na2O2═2Na2CO3+O2,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故有1molNa2O2完全反应,转移的电子数为 1mol×
×2×[(0-(-1)]=1mol,
故答案为:2CO2+2Na2O2═2Na2CO3+O2;1;
(3)G→E为稀硝酸和铜的反应,方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,用双线桥标出电子转移的方向和数目为: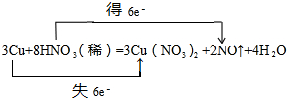 ,
,
故答案为: ;
;
(4)将等物质的量的NO、NO2混合气通入NaOH溶液中,恰好被吸收,生成一种钠盐,令该盐中N元素化合价为x,根据电子转移守恒可知:x-2=4-x,解得x=3,故生成NaNO2,该反应的化学方程式为:NO+NO2+2NaOH═2NaNO2+H2O,
故答案为:NO+NO2+2NaOH═2NaNO2+H2O;
(5)实验室里,检验NH4HCO3中阳离子的方法是:取少量X于试管中,加入NaOH溶液,然后加热试管,再将湿润的红色石蕊试纸放在试管口,放出的气体能使湿润的红色石蕊试纸变蓝,则可说明其中有铵根离子,
故答案为:取少量X于试管中,加入NaOH溶液,然后加热试管,再将湿润的红色石蕊试纸放在试管口,放出的气体能使湿润的红色石蕊试纸变蓝,则可说明其中有铵根离子;
(6)120℃时,NH4HCO3完全分解生成NH3、H2O(气体)、CO2的物质的量之比为1:1:1,故混合产物的平均相对分子量=
=26.3,
故答案为:26.3.
(1)由以上分析可知,X为NH4HCO3,B为H2O,F为NO2,
故答案为:NH4HCO3;H2O;NO2;
(2)A→D为Na2O2和CO2的反应,方程式为2CO2+2Na2O2═2Na2CO3+O2,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故有1molNa2O2完全反应,转移的电子数为 1mol×
| 1 |
| 2 |
故答案为:2CO2+2Na2O2═2Na2CO3+O2;1;
(3)G→E为稀硝酸和铜的反应,方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,用双线桥标出电子转移的方向和数目为:
 ,
,故答案为:
 ;
;(4)将等物质的量的NO、NO2混合气通入NaOH溶液中,恰好被吸收,生成一种钠盐,令该盐中N元素化合价为x,根据电子转移守恒可知:x-2=4-x,解得x=3,故生成NaNO2,该反应的化学方程式为:NO+NO2+2NaOH═2NaNO2+H2O,
故答案为:NO+NO2+2NaOH═2NaNO2+H2O;
(5)实验室里,检验NH4HCO3中阳离子的方法是:取少量X于试管中,加入NaOH溶液,然后加热试管,再将湿润的红色石蕊试纸放在试管口,放出的气体能使湿润的红色石蕊试纸变蓝,则可说明其中有铵根离子,
故答案为:取少量X于试管中,加入NaOH溶液,然后加热试管,再将湿润的红色石蕊试纸放在试管口,放出的气体能使湿润的红色石蕊试纸变蓝,则可说明其中有铵根离子;
(6)120℃时,NH4HCO3完全分解生成NH3、H2O(气体)、CO2的物质的量之比为1:1:1,故混合产物的平均相对分子量=
| 79 |
| 3 |
故答案为:26.3.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目