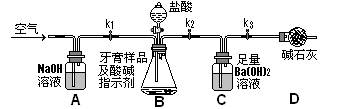
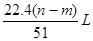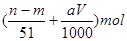题目内容
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5 ∶6,则甲、乙两烧杯中的反应情况可能分别为( )
| A.甲、乙中都是铝过量 | B.甲中铝过量,乙中碱过量 |
| C.甲中酸过量,乙中铝过量 | D.甲中酸过量,乙中碱过量 |
D
正确答案:D
3H2SO4+2Al=Al2(SO4)3+3H2
那么1molH2SO4对应2/3mol铝原子
2NaOH+2Al+2H2O= 2NaAlO2+H2
那么1molNaOH对应1mol铝原子
因为等物质的量,所以碱等物质的量要比硫酸溶解的铝要多。所以酸都过量,碱肯定也过量,相反,只要碱不足,酸更不足。下面用极值法来分析:
如果酸过量,那么碱肯定过量,(碱只需要消耗1mol就能溶解1mol铝),那么产生的氢气比是1:1,因为还原剂铝完全反应对应的氢气是一样的1:1
如果碱不足,那么酸肯定不足,那么产生的H2比例就是1mol氢氧根对应1mol铝对应1.5molH2,而1mol硫酸分子对应1mol氢气H2.所以产生氢气的比例就是2:3,
实际比例5:6,介于两者之间,那么肯定是碱过量,酸不足。D正确。

练习册系列答案
相关题目
 验完成下列问题:
验完成下列问题: