题目内容
【题目】根据反应Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,回答下列问题:
CuSO4+SO2↑+2H2O,回答下列问题:
(1)用“双线桥法”标出电子转移的方向和数目________________。
(2)请用化学式写出该反应中的还原剂是__________;氧化剂是__________;氧化产物是__________。
(3)还原剂和还原产物物质的量之比__________。
【答案】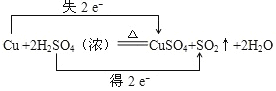 Cu H2SO4 CuSO4 1:1
Cu H2SO4 CuSO4 1:1
【解析】
在Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,失电子被氧化,S元素化合价降低,得电子被还原;所含元素化合价升高,失电子的物质作还原剂,还原剂对应的是氧化产物;所含元素化合价降低,得电子的物质作氧化剂,氧化剂对应的是还原产物。
CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,失电子被氧化,S元素化合价降低,得电子被还原;所含元素化合价升高,失电子的物质作还原剂,还原剂对应的是氧化产物;所含元素化合价降低,得电子的物质作氧化剂,氧化剂对应的是还原产物。
(1)该氧化还原反应中,得电子的元素是硫,化合价降低2价,失电子的元素是铜,化合价升高2价,所以转移电子2mol,如图所示:
故答案为: 
(2)在氧化还原反应中,所含元素化合价升高,失电子的物质作还原剂,还原剂对应的是氧化产物;所含元素化合价降低,得电子的物质作氧化剂,氧化剂对应的是还原产物;所以还原剂是Cu;氧化剂是H2SO4;氧化产物是CuSO4; 故答案为: Cu ;H2SO4 ; CuSO4 ;
(3)还原剂是Cu,还原产物是SO2,还原剂和还原产物物质的量之比为:1:1,故答案为:1:1。

【题目】硫酸亚铁铵又称莫尔盐,是浅绿色晶体.它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂.某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度.
已知:①
| 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO47H2O | 40.0 | 48.0 | 60.0 | 73.3 | ﹣ | ﹣ |
(NH4)2SO4FeSO46H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
②莫尔盐在乙醇溶剂中难溶.
Ⅰ.莫尔盐的制取

试分析:
(1)必须在铁屑少量剩余时进行过滤,其原因是______________________.
(2)步骤3中包含的实验操作名称_____________________.
(3)产品莫尔盐最后用______________________ 洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液。根据物质组成甲、乙、丙三位同学设计了如下三个实验方案,请回答:
方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL﹣1的酸性KMnO4溶液分三次进行滴定.
方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.
![]()
(4)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为_________,验证推测的方法为:___________________________________________方案三:(通过NH4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.

(5)装置___________ (填“甲”或“乙”)较为合理,判断理由是_______________.
(6)量气管中最佳试剂是__________ (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
(7)若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为_______.