��Ŀ����
����Ŀ��ͬһ���ڵ�A��B��C��D��EΪԭ��������������Ķ�����Ԫ�أ���֪A��B��E 3��ԭ������㹲��11�����ӣ�����3��Ԫ�ص�����������ˮ�����������ܷ�����Ӧ�����κ�ˮ��CԪ�ص������������ȴ�����������4��DԪ��ԭ�Ӵ�����������������������3��
��1��д������Ԫ�ط��ţ�A ____________ ��B_____________��C____________��D___________��E_____________
��2��A��E��Ԫ�ؿ��γɻ��������õ���ʽ��ʾ�仯������γɹ�����________________________________
��3��д��A��B��Ԫ������������Ӧ��ˮ�������Ӧ�Ļ�ѧ����ʽ��___________________________________
���𰸡� Na Al Si P Cl ![]() Al(OH)3+ NaOH = NaAlO2+2H2O
Al(OH)3+ NaOH = NaAlO2+2H2O
��������A��B��C��D��EΪԭ��������������Ķ�����Ԫ����CԪ�ص������������ȴ�����������4����CԪ��ԭ����3�����Ӳ�������������Ϊ4����CΪSiԪ����DԪ��ԭ���������ڹ�Ԫ�������ڵ���������DԪ��ԭ�Ӵ�����������������������3��������������Ϊ8-3=5����DΪ��Ԫ����A��B��E����Ԫ�ص�����������ˮ�����������ܷ�����Ӧ�����κ�ˮ������AlԪ����������������ǿ�ᡢǿ��������NaԪ������AΪNa��BΪAl������ԭ������㹲��11����������E������������Ϊ11-1-3=7����EΪClԪ����
(1)�����Ϸ�������֪����AΪNa��BΪAl��CΪSi��DΪP��EΪCl����ȷ����Na �� Al �� Si�� P �� Cl��
(2)A��E��Ԫ�ؿ��γɻ�����ΪNaCl���õ���ʽ��ʾ�仯������γɹ���Ϊ![]() ����ȷ����:
����ȷ����:![]() ��
��
(3)A��B��Ԫ������������ˮ����ֱ�Ϊ:![]() ��
��![]() ,������������������,�ʷ�Ӧ�ķ���ʽΪ��Al(OH)3+ NaOH = NaAlO2+2H2O����ȷ��: Al(OH)3+ NaOH = NaAlO2+2H2O ��
,������������������,�ʷ�Ӧ�ķ���ʽΪ��Al(OH)3+ NaOH = NaAlO2+2H2O����ȷ��: Al(OH)3+ NaOH = NaAlO2+2H2O ��

 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش��������⣺
���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1������ЩԪ���У���������ǿ��Ԫ����_____������õķǽ���Ԫ����_______________
��2����ѧ��������õ�Ԫ����______________����ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ___________��
��3��Ԫ�ص�����������Ӧ��ˮ������������ǿ����______________��������ǿ����____________��
��4���ڢۡ���Ԫ���У�ԭ�Ӱ뾶������________��ԭ�Ӱ뾶��С����_______��
����Ŀ���±���Ԫ�����ڱ���ǰ�����ڣ�
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0[ | |
һ | A | |||||||
�� | B | C | D | E | F | |||
��[ | G | H | I | J |
�ش��������⣺
��1��JԪ�ص�Ԫ�ص����ƣ�___________��
��2��GԪ����I Ԫ���γɵĻ�����ĵ���ʽ��___________��
A��G��E�γɵĻ������к��еĻ�ѧ������Ϊ_____________________________��
��3��������ʮ��Ԫ�ص�����������Ӧ��ˮ�����У�������ǿ����_____________��
�������������������_______________���û�����Ļ�ѧʽ��ʾ����
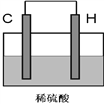
��4����H������C��һ�ֵ��ʣ����壩������ͼװ�����ӣ�����C��Ϊ_________��������������д���õ缫��ӦʽΪ��____________________��