题目内容
14.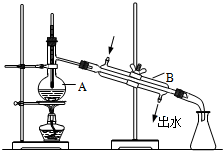 如图为实验室制取蒸馏水的装置示意图,请根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,请根据图示回答下列问题.(1)图中有两处明显的错误分别是
①温度计水银球没在蒸馏烧瓶支管口
②冷凝管冷却水进出水口错
(2)图中A仪器的名称是蒸馏烧瓶,
(3)实验时A中除加入自来水外,还需加入少量沸石,其作用是防止暴沸.
(4)区别自来水和蒸馏水可用的试剂是稀硝酸和硝酸银溶液.
分析 (1)蒸馏操作中,温度计应该放在蒸馏烧瓶的支管口处;冷凝管的通水方向应该为自下而上;
(2)根据A的构造可知其名称为蒸馏烧瓶;
(3)蒸馏时,需要在混合液中加入沸石,目的是防止暴沸;
(4)自来水中含有氯离子,而蒸馏水中不含氯离子,可通过检验氯离子区别蒸馏水和蒸馏水.
解答 解:(1)蒸馏装置中,温度计应该放在蒸馏烧瓶的支管口处,图示装置中温度计水银球没在蒸馏烧瓶支管口;冷凝管冷却水进出水口错,应该采用逆向通水的方式,即:从冷凝管的下口入水、上口出水,
故答案为:温度计水银球没在蒸馏烧瓶支管口;冷凝管冷却水进出水口错;
(2)根据图示可知,仪器A的名称为蒸馏烧瓶,
故答案为:蒸馏烧瓶;
(3)混合液在加热过程中易发生爆沸现象,所以在蒸馏操作中避免发生爆沸现象,需要加入沸石,
故答案为:沸石;防止暴沸;
(4)蒸馏水中不含氯离子,而自来水中含有氯离子,故可用稀硝酸和硝酸银溶液通过检验是否含有氯离子来判断是蒸馏水还是自来水,
故答案为:稀硝酸和硝酸银溶液.
点评 本题考查了蒸馏水的制取方法及常见仪器的构造、使用方法,题目难度中等,明确化学实验基本操作方法为解答关键,注意掌握蒸馏水的制取方法及常见仪器的构造,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
4.CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等.
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)═CaO2(s)+2H2O(l);△H<0
不同浓度的H2O2对反应生成CaO2产率的影响如表:
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:H2O2浓度高,反应速率快,反应放热使体系温度迅速升高,加快H2O2发生分解.
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量.
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2mL盐酸(3mol•L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mL KI溶液(100g•L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后加入指示剂淀粉溶液,用硫代硫酸钠标准溶液继续滴定,直至溶液的蓝色恰好消失且半分钟内颜色不变,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数.滴定时发生的反应为2Na2S2O3+I2═Na2S4O6+2NaI.
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是生成微溶的CaSO4覆盖在过氧化钙表面,使结果不准确.
(3)加入KI溶液后发生反应的离子方程式为H2O2+2I-+2H+═I2+2H2O.
(4)请补充完整实验步骤4中的内容:加入指示剂淀粉溶液;直至溶液的蓝色恰好消失且半分钟内颜色不变.
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)═CaO2(s)+2H2O(l);△H<0
不同浓度的H2O2对反应生成CaO2产率的影响如表:
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量.
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2mL盐酸(3mol•L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mL KI溶液(100g•L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后加入指示剂淀粉溶液,用硫代硫酸钠标准溶液继续滴定,直至溶液的蓝色恰好消失且半分钟内颜色不变,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数.滴定时发生的反应为2Na2S2O3+I2═Na2S4O6+2NaI.
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是生成微溶的CaSO4覆盖在过氧化钙表面,使结果不准确.
(3)加入KI溶液后发生反应的离子方程式为H2O2+2I-+2H+═I2+2H2O.
(4)请补充完整实验步骤4中的内容:加入指示剂淀粉溶液;直至溶液的蓝色恰好消失且半分钟内颜色不变.
5.反应2SO2+O2?2SO3在一定条件下反应一段时间后,SO3的浓度增加了0.8mol/L,在这段时间内用O2表示的反应速率为0.1mol•L-1•s-1,则这段反应时间为( )
| A. | 2.5s | B. | 4s | C. | 5s | D. | 10s |
2.下列关于反应热的说法正确的是( )
| A. | 已知C(石墨,s)═C(金刚石,s)△H﹦+1.9kJ•mo1-1,说明金刚石具有的能量比石墨低 | |
| B. | 已知H+(aq)+OH-(aq)═H2O(1)△H﹦-57.4KJ•mo1-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ | |
| C. | 已知甲烷的燃烧热为890.3kJ•mo1-1,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H﹦-890.3kJ•mo1-1 | |
| D. | 将0.5mo1N2和1.5mo1H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H﹦-38.6kJ•mo1-1 |
9.某有机物的结构简式为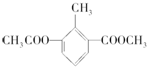 ,关于该物质的叙述错误的是( )
,关于该物质的叙述错误的是( )
 ,关于该物质的叙述错误的是( )
,关于该物质的叙述错误的是( )| A. | 一分子该物质中含有12个H原子 | |
| B. | 该物质的一氯代物有4种 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1 mol该物质分别与足量H2、NaOH溶液反应,消耗H2、NaOH的物质的量均为3mol |
6.金属材料在日常生活以及生产中有着广泛的应用.下列有关金属及其化合物的说法中正确的是( )
| A. | 金属钠不慎着火,可用泡沫灭火器来灭火或湿布盖灭 | |
| B. | 往FeCl3溶液中滴入KI淀粉溶液,溶液变蓝色 | |
| C. | 铝粉和MgO或Cr2O3粉末混合,高温能发生铝热反应 | |
| D. | 向紫色石蕊试液中加入Na2O2粉末,振荡后溶液变为蓝色并产生气泡 |
3.下列实验不能达到目的是( )
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 只用少量水就可鉴别Na2CO3和NaHCO3固体 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备较纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
4.1mol H2SO4中氧原子数( )
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 4 mol |
 .
.