题目内容
【题目】甲苯是重要的基础化工原料,下图是大学化学教材《有机化学基础》上由甲苯合成J的一种合成路线。
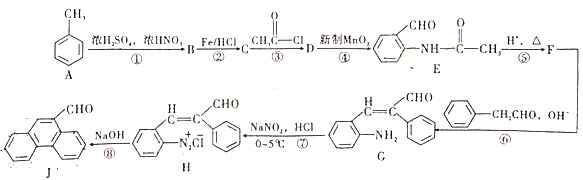
请依据上述流程回答以下问题
(1)B的化学名称为___________,J的分子式为___________。
(2)D生成E的反应类型为___________。
(3)设计第③步和第⑤步的目的是______________。
(4)由H生成J过程中生成的无机物除了![]() 外还有_________。
外还有_________。
(5)写出C→D的反应方程式为_______。
(6)D的同分异构体有多种。其中含有苯环和碳氧双键,且核磁共振氢谱有四组峰的有_________种。(不考虑立体异构)
(7)请依据流程图中相关信息,写出由甲苯和乙醛制备![]() 的合成路线________。(无机试剂任选)
的合成路线________。(无机试剂任选)
【答案】邻硝基甲苯 C15H10O 氧化反应 保护氨基、防止-NH2被氧化 NaCl、H2O 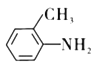 +
+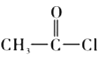 →
→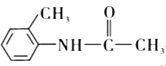 +HCl 6
+HCl 6 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
根据E的结构简式,可知甲苯与浓硝酸在浓硫酸的作用下,生成B为邻硝基甲苯;邻硝基甲苯与HCl在Fe的作用下,硝基转变为氨基;C与CH3COCl反应生成D,即![]() ;E在酸性条件下,重新还原为氨基,即
;E在酸性条件下,重新还原为氨基,即![]() 。据此解答。
。据此解答。
(1)结合前后可判断硝基取代在邻位,故B为邻硝基甲苯;根据J的结构简式可知,分子式为C15H10O。
(2)新制MnO2作氧化剂将D中的甲基氧化为醛基,故反应类型为氧化反应。
(3)氨基具有还原性,为了防止在将甲基氧化为醛基的过程中将氨基氧化,需要保护氨基,设计第③步和第⑤步的目的就是保护氨基。
(4)根据原子守恒和电荷守恒可判断产物还有NaCl和H2O。
(5)该反应为取代反应,方程式为![]() +
+![]() →
→![]() +HCl。
+HCl。
(6)满足条件的有 、
、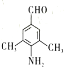 、
、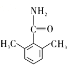 、
、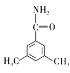 、
、 、
、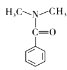 ,共6种。
,共6种。
(7)结合流程图中D→E和F→G的信息,甲苯被氧化为苯甲醛时,才可与乙醛发生碳链增长,可设计合成路线如下![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补血剂。实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁。有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物,相对分子质量为75 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶乙醇 |
Ⅰ.配制FeSO4溶液
用绿矾(FeSO4·7H2O)配制100mL1.00mol·L-1的FeSO4溶液。
(1)除托盘天平、药匙、烧杯、玻璃棒、量筒外,还需要的仪器有__。
Ⅱ.制备FeCO3
将配制好的绿矾溶液倒入烧杯中,缓慢加入200mL1.10mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
(2)反应的离子方程式为__。
Ⅲ.制备(NH2CH2COO)2Fe
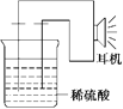
制备装置如图所示(夹持和加热仪器已省略)。将Ⅱ中制备得到的FeCO3转移到装置D的三颈烧瓶中,检查气密性后,按如图所示加入足量的相关试剂,按以下操作进行实验。
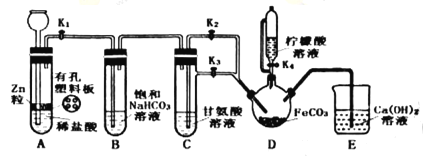
(3)关闭K2、打开K1、K3,此操作的目的是__;
(4)当观察到装置E中出现浑浊后,关闭K3、打开K2,此时可观察到的现象是__;
(5)关闭K1、K2、K3,打开K4,向三颈烧瓶中加入柠檬酸溶液,加热,使反应发生。加入柠檬酸溶液的目的除了调节溶液的pH促进FeCO3溶解,另一目的是__;
(6)反应结束后,将三颈烧瓶中所得到的混合物过滤,滤液经___(填操作)、过滤、洗涤、干燥得到产品。洗涤操作所选用的最佳洗涤试剂是__。
A.蒸馏水 B.乙醇 C.FeSO4溶液 D.柠檬酸溶液
Ⅳ.产率计算
(7)若得到的产品质量为17.96g,则产率为__。