题目内容
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补血剂。实验室以绿矾(FeSO4·7H2O)为铁源制备补血剂甘氨酸亚铁。有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物,相对分子质量为75 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶乙醇 |
Ⅰ.配制FeSO4溶液
用绿矾(FeSO4·7H2O)配制100mL1.00mol·L-1的FeSO4溶液。
(1)除托盘天平、药匙、烧杯、玻璃棒、量筒外,还需要的仪器有__。
Ⅱ.制备FeCO3
将配制好的绿矾溶液倒入烧杯中,缓慢加入200mL1.10mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
(2)反应的离子方程式为__。
Ⅲ.制备(NH2CH2COO)2Fe
制备装置如图所示(夹持和加热仪器已省略)。将Ⅱ中制备得到的FeCO3转移到装置D的三颈烧瓶中,检查气密性后,按如图所示加入足量的相关试剂,按以下操作进行实验。
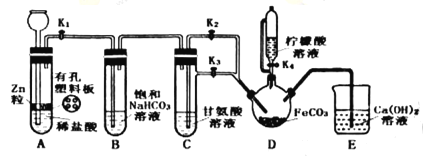
(3)关闭K2、打开K1、K3,此操作的目的是__;
(4)当观察到装置E中出现浑浊后,关闭K3、打开K2,此时可观察到的现象是__;
(5)关闭K1、K2、K3,打开K4,向三颈烧瓶中加入柠檬酸溶液,加热,使反应发生。加入柠檬酸溶液的目的除了调节溶液的pH促进FeCO3溶解,另一目的是__;
(6)反应结束后,将三颈烧瓶中所得到的混合物过滤,滤液经___(填操作)、过滤、洗涤、干燥得到产品。洗涤操作所选用的最佳洗涤试剂是__。
A.蒸馏水 B.乙醇 C.FeSO4溶液 D.柠檬酸溶液
Ⅳ.产率计算
(7)若得到的产品质量为17.96g,则产率为__。
【答案】100mL容量瓶、胶头滴管 Fe2++2HCO3-=FeCO3↓+CO2+H2O 用H2排除装置中的空气,防止氧气干扰实验 C中的溶液被压入D中 防止二价铁被氧化 蒸发浓缩,冷却结晶 D 88%
【解析】
根据配制一定物质的量浓度溶液的实验分析解答;根据题给信息及实验目的、装置分析解答;根据滴定原理计算产率。
(1)配制一定物质的量浓度的溶液还需要的仪器为 容量瓶和胶头滴管,故答案为:100mL容量瓶、胶头滴管;
(2)根据题给信息知硫酸亚铁和NH4HCO3反应生成碳酸亚铁沉淀,则反应的离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2+H2O,故答案为:Fe2++2HCO3-=FeCO3↓+CO2+H2O;
(3)根据实验装置分析,装置A作用是制取H2,实验过程中Fe2+易被空气中氧气氧化,所以可以用H2排出空气,故答案为:用H2排除装置中的空气,防止氧气干扰实验;
(4)D中澄清石灰水变浑浊,说明装置内空气排尽,关闭K3、打开K2,H2将C中的溶液被压入D中,故答案为:C中的溶液被压入D中;
(5)柠檬酸具有还原性,可以防止二价铁被氧化,故答案为:防止二价铁被氧化;
(6)由于甘氨酸亚铁易溶于水,且易被氧化,所以从滤液中分离出来的方法为蒸发浓缩,冷却结晶;由于甘氨酸亚铁易溶于水,难溶于乙醇,用乙醇洗涤产品可以减少产品的溶解,提高产率和纯度;故答案为:蒸发浓缩,冷却结晶;B;
(7)根据铁原子守恒知理论上产生的(NH2CH2COO)2Fe的物质的量为: n[(NH2CH2COO)2Fe]=n(FeCO3)=n(FeSO4)=0.1L×1.00mol·L-1=0.10mol,则产率为![]() ,故答案为:88%。
,故答案为:88%。