题目内容
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2) H2O以 键结合(填极性键、非极性键、离子键)
(3)在pH=1的溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(4)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑ D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(5)已知KH和H2O反应生成H2和KOH,反应中1mol KH (填失去,得到) mol电子
(6)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
(15分) (1) 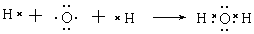 (2分) (2)极性键(1分)
(2分) (2)极性键(1分)
(3)①③ (2分)(4)CD(2分) AB(2分) (5)失去(1分) 1(1分)
(6)H2 +2OH - -2e-=2H2O(2分) 200NA (2分)
【解析】
试题分析:(1)水是以极性键结合的共价化合物,则用电子式表示H2O的形成过程为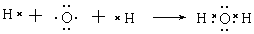 。
。
(3)溶液显酸性,则HCO3-不能大量共存。另外在酸性条件下,NO3-具有强氧化性,能氧化Fe2+,所以一定大量共存的是①③。
(4)在氧化还原反应中,氧化剂得到电子,元素的化合价降低。还原剂失去电子,元素的化合价升高,据此可知A、B中水水既不做氧化剂又不做还原剂的是,CD中水是氧化剂。
(5)KH中H元素的化合价是-1价,反应后变为0价,所以反应中1mol KH失去1mol电子。
(6)原电池中负极失去电子,则氢气在负极通入,电极反应式是H2 +2OH - -2e-=2H2O。生成1mol水转移2mol电子,1.8L水的物质的量是1800g÷18g/mol=100mol,所以反应中转移电子的个数是200NA。
考点:考查电子式、电极反应式、氧化还原反应的有关判断和计算
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的检验。该题主要是以水为载体,重点考查学生对电子式、氧化还原反应以及原电池原理的熟悉了解程度,意在巩固学生的基础,提高学生分析、归纳、总结问题的能力,有利于调动学生的学习兴趣和学习积极性。

2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2) H2O以 键结合(填极性键、非极性键、离子键)
(3)在pH=1的溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(4)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
| A.Cl2+H2O=HCl+HClO | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(6)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
 H3O++OH-
H3O++OH- Fe3O4+4H2
Fe3O4+4H2
 Fe3O4+4H2
Fe3O4+4H2