题目内容
(16分)2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)水分子自身作用会生成阴、阳两种离子,其中阳离子的电子式是 。
(2)在由水电离产生的c(H+)=1×10-14 mol·L-1的溶液中,①NH4+、Al3+、Br-、SO42-
② Na+、Mg2+、Cl-、NO3-③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定可以大量共存的是 (填序号,下同),可能大量共存的是 。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.Cl2+H2O=HCl+HClO
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
(5)右图是某品牌饮用矿泉水标签的部分内容。请认真阅读标签内容后计算。

①该矿泉水中镁离子的物质的量浓度的最大值是 ;
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过 mol。
(16分)(1)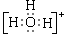 (1分)
(2)③;①②
(3)CD;AB
(1分)
(2)③;①②
(3)CD;AB
(4)2H2+4OH--4e-=4H2O 电子数1.204×1026(1分)
(5)①2×10-4mol·L -1 ②1×10-4mol
【解析】
试题分析:(1)水分子自身作用会生成阴、阳两种离子,电离方程式是H2O+H2O H3O++OH-,所以阳离子的电子式是
H3O++OH-,所以阳离子的电子式是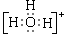 。
。
(2)由水电离产生的c(H+)=1×10-14 mol·L-1的溶液中,水的电离是被抑制的,溶液可能显酸性,也可能显碱性。如果显酸性HCO3-不能大量共存;如果显碱性,Al3+、Mg2+、HCO3-不能大量共存。所以一定可以大量共存的是③,可能大量共存的是①②。
(3)在氧化还原反应中物质所含元素化合价升高的是还原剂,物质所含元素化合价降低的是氧化剂,所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是AB。
(4)原电池中负极失去电子,发生氧化反应,所以氢气在负极通入。由于电解质溶液显碱性,因此在氢氧燃料电池中负极的电极反应式为2H2+4OH--4e-=4H2O。1.8L水的物质的量是1800g÷18g/mol=100mol,所以转移100mol×2=200mol电子,其个数是1.204×1026。
(5)①镁离子的最大值是4.8mg/L,所以其浓度就是0.0048÷24=2×10-4mol·L -1。
②根据标签可知,一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过0.0192g/L×0.5L÷96g/mol=1×10-4mol。
考点:考查水的电离、离子共存、氧化剂和还原剂的判断及物质的量的有关计算等
点评:在氧化还原反应的有关判断中,关键是准确标出有关元素的化合价变化,然后根据有关知识灵活运用即可。

2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2) H2O以 键结合(填极性键、非极性键、离子键)
(3)在pH=1的溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(4)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
| A.Cl2+H2O=HCl+HClO | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(6)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
 H3O++OH-
H3O++OH- Fe3O4+4H2
Fe3O4+4H2 Fe3O4+4H2
Fe3O4+4H2