题目内容
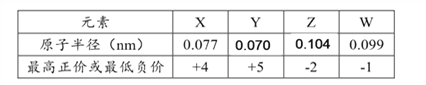
【题目】四种短周期元素A、B、C、D,原子序数依次增大,A原子的最外电子层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A元素最高价氧化物的电子式为_________,D元素的某种核素中质子数和中子数相等,该核素组成符号为_______。
(2)化合物E中存在的化学键类型为_________。
(3)A、B、C的原子半径从大到小的顺序__________________。(用对应原子符号表示);B、C、D 的简单离子的半径从大到小的顺序__________________。(用对应的离子符号表示)
【答案】 ![]()
![]() 离子键和(非极性)共价键 Na>C>O S2->O2->Na+
离子键和(非极性)共价键 Na>C>O S2->O2->Na+
【解析】四种短周期元素A、B、C、D的原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则B为O元素、C为Na元素,E为Na2O2,A原子的最外电子层上有4个电子且原子序数小于O元素,则A为C元素,D的L层电子数等于K、M两个电子层上电子数之和,D为S元素。
(1). C元素的最高价氧化物是CO2,电子式为![]() ,S是16号元素,质子数为16,质子数和中子数相等,则中子数也为16,质量数为32,该核素组成符号为
,S是16号元素,质子数为16,质子数和中子数相等,则中子数也为16,质量数为32,该核素组成符号为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2).化合物E是Na2O2,该物质中存在离子键和(非极性)共价键,故答案为:离子键和(非极性)共价键;
(3).根据元素周期律,同一周期随原子序数的增大原子半径逐渐减小,同一主族随原子序数的增大原子半径逐渐增大,则C、O、Na的原子半径从大到小的顺序为Na>C>O,O2-和Na+具有相同的电子层结构,原子序数越大,离子半径越小,则离子半径O2->Na+,S元素和O元素位于同一主族,S2-比O2-多一个电子层,离子半径S2->O2-,所以离子半径S2->O2->Na+,故答案为:Na>C>O;S2->O2->Na+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列各物质的分类、名称(或俗名)、化学式都正确的是( )
分类 | 名称(俗名) | 化学式 | |
A | 碱性氧化物 | 氧化铁 | FeO |
B | 酸性氧化物 | 碳酸气 | CO |
C | 酸 | 硫酸 | H2SO3 |
D | 盐 | 纯碱 | Na2CO3 |
A. AB. BC. CD. D