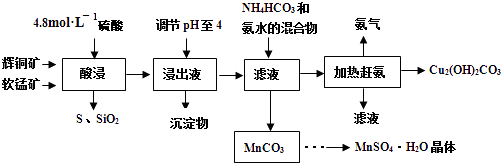
题目内容
【题目】某学习小组进行了如图所示的实验,设第一步HNO3的还原产物只有NO.相关分析不正确的是( ) 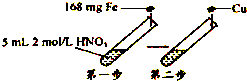
A.第一步反应后溶液中c(NO ![]() )=1.5mol/L(忽略体积变化)
)=1.5mol/L(忽略体积变化)
B.第一步反应后溶液中c(Fe2+):c(Fe3+)=1:1
C.第一步可生成标准状况下的气体44.8 mL
D.第二步可溶解铜48mg
【答案】C
【解析】解:n(Fe)= ![]() =0.003mol,n(HNO3)=0.005L×2mol/L=0.01mol,HNO3的还原产物只有NO,Fe氧化为铁离子消耗硝酸最大为0.003×3+
=0.003mol,n(HNO3)=0.005L×2mol/L=0.01mol,HNO3的还原产物只有NO,Fe氧化为铁离子消耗硝酸最大为0.003×3+ ![]() =0.012mol,若转化为亚铁离子,消耗硝酸为0.003mol×2+
=0.012mol,若转化为亚铁离子,消耗硝酸为0.003mol×2+ ![]() =0.008mol,即第一步反应后溶液中含亚铁离子、铁离子,设混合溶液中Fe2+、Fe3+的物质的量分别为x、y,则
=0.008mol,即第一步反应后溶液中含亚铁离子、铁离子,设混合溶液中Fe2+、Fe3+的物质的量分别为x、y,则 ![]() ,
,
解得x=y=0.0015mol,
A.生成均为0.0015molFe(NO3)2、Fe(NO3)3 , 则第一步反应后溶液中c(NO3﹣)= ![]() =1.5mol/L,故A正确;
=1.5mol/L,故A正确;
B.生成均为0.0015molFe(NO3)2、Fe(NO3)3 , 则第一步反应后溶液中c(Fe2+):c(Fe3+)=1:1,故B正确;
C.由电子守恒可知,生成NO为 ![]() ×22.4L/mol=0.056L=56mL,故C错误;
×22.4L/mol=0.056L=56mL,故C错误;
D.第二步发生Cu+2Fe3+=2Fe2++Cu2+ , 溶解Cu为0.0015mol× ![]() ×64g/mol=48mg,故D正确;
×64g/mol=48mg,故D正确;
故选C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目