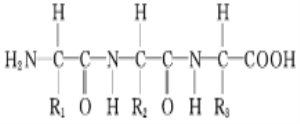
题目内容
【题目】下图是元素周期表的一部分,在① ~⑩元素中,试用元素符号或化学式等化学用语回答下列问题:
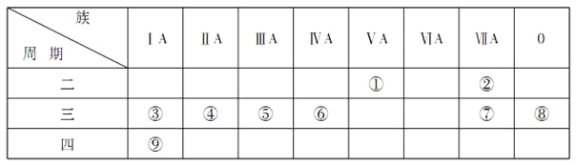
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是,碱性最强的是
(3)用电子式表示②与④形成化合物的过程
(4)单质⑤与③的最高价氧化物对应的水化物反应的离子方程式是
(5)①和⑥形成的化合物是一种新型的高温结构陶瓷,该化合物中含有的化学键类型是
(6)②③和⑦元素的原子半径由大到小的顺序是__________,它们形成的简单离子中,离子半径由大到小的顺序是____
【答案】(1)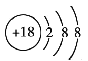 ;(2)HClO4,KOH;
;(2)HClO4,KOH;
(3)![]() ;
;
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑;(5)共价键(或极性键);
(6)Na>Cl>F,Cl->F->Na+。
【解析】试题分析:(1)根据元素周期表,最不活泼的元素是⑧,即为Ar,它属于稀有气体,第18号元素,乙原子结构示意图为: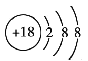 ;(2)同周期从左向右非金属性增强,金属性减弱,同主族从上到下金属性增强,非金属性减弱,即最高价氧化物对应水化物酸性越强,非金属性越强,即为⑦HClO4,因为F没有正价,最高价氧化物对应水化物的碱性最强,金属性最强,即⑨KOH;(3)②④形成的化合物为MgF2,属于离子化合物,其电子式形成的过程为:
;(2)同周期从左向右非金属性增强,金属性减弱,同主族从上到下金属性增强,非金属性减弱,即最高价氧化物对应水化物酸性越强,非金属性越强,即为⑦HClO4,因为F没有正价,最高价氧化物对应水化物的碱性最强,金属性最强,即⑨KOH;(3)②④形成的化合物为MgF2,属于离子化合物,其电子式形成的过程为:![]() ;(4)⑤为Al,③的最高价氧化物对应水化物为NaOH,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(5)①⑥形成的Si3N4,含有共价键;(6)半径比较:一看电子层数,电子层数越多,半径越大,二看核电荷数,电子层数相等,半径随着原子序数的递增而减小,Na>Cl>F,Cl->F->Na+。
;(4)⑤为Al,③的最高价氧化物对应水化物为NaOH,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(5)①⑥形成的Si3N4,含有共价键;(6)半径比较:一看电子层数,电子层数越多,半径越大,二看核电荷数,电子层数相等,半径随着原子序数的递增而减小,Na>Cl>F,Cl->F->Na+。

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目