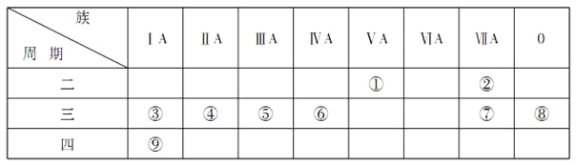
题目内容
【题目】在含c(NH4Cl)=3c(AlCl3)的溶液中滴加稀NaOH溶液。下列离子方程式不符合实际情况的是( )
A. Al3++3NH![]() +6OH-===Al(OH)3↓+3NH3·H2O
+6OH-===Al(OH)3↓+3NH3·H2O
B. Al3++5NH![]() +9OH-===5NH3·H2O+AlO
+9OH-===5NH3·H2O+AlO![]() +7H2O
+7H2O
C. 2Al3++NH![]() +7OH-===2Al(OH)3↓+NH3·H2O
+7OH-===2Al(OH)3↓+NH3·H2O
D. Al3++3NH![]() +7OH-===AlO
+7OH-===AlO![]() +3NH3·H2O+2H2O
+3NH3·H2O+2H2O
【答案】B
【解析】试题分析:在含c(NH4Cl)=3c(AlCl3)的溶液中,氨根离子与铝离子物质的量之比为3:1,A.向溶液中加入氢氧化钠,氢氧化钠先与铝离子反应生成氢氧化铝,然后再与氨根离子反应生成一水合氨,则反应的离子方程式:Al3++3NH4++6OH-=Al(OH)3↓+3NH3H2O,A正确;B.溶液中有1mol铝离子,则溶液中含有3mol氨根离子,离子个数比不符合,B错误;C.加入7mol氢氧化钠,先与2mol铝离子发生反应:
2Al3++6OH-=2Al(OH)3↓,剩余1mol氢氧化钠只能反应1mol氨根离子反应,离子方程式:NH4++OH-=NH3H2O,合在一起为:2Al3++NH4++7OH-=2Al(OH)3+NH3H2O,C正确;D.1mol铝离子、3mol氨根离子完全反应生成偏铝酸根离子和一水合氨需要消耗氢氧化钠7mol,所以当向溶液中加入的氢氧化钠的物质的量是铝离子物质的量的7倍以上时发生的反应离子方程式为:Al3++2NH4++6OH-=AlO2-+2NH3H2O+2H2O,D正确;答案选B。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】为探究影响化学反应速率的影响因素,将等质量的铁与过量盐酸反应,其他实验条件见下表。其中铁被反应完消耗时间最少的组别是
组别 | c(HCl)/ mol·L-1 | 温度/℃ | 铁的状态 |
A | 2.0 | 25 | 块状 |
B | 2.5 | 30 | 粉末状 |
C | 2.5 | 50 | 块状 |
D | 2.5 | 50 | 粉末状 |
A. A B. B C. C D. D