题目内容
【题目】某氯原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
(1)该氯原子的相对原子质量为![]() (2)m g该氯原子的物质的量为
(2)m g该氯原子的物质的量为![]() mol
mol
(3)该氯原子的摩尔质量是aNA g (4)a g该氯原子所含的电子数为17NA
A. (1)(3) B. (1)(2) C. (2)(4) D. (2)(3)
【答案】B
【解析】(1)该氯原子的相对原子质量=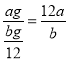 ,故(1)正确;(2)1mol碳原子的个数是NA,n=m/M=
,故(1)正确;(2)1mol碳原子的个数是NA,n=m/M=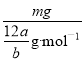 =m/aNAmol,故(2)正确;(3)摩尔质量在数值上等于其相对原子质量,也等于1mol原子含有的质量,所以该硫原子的摩尔质量是aNA g·mol-1,故(3)错误;(4)a g该氯原子的个数=
=m/aNAmol,故(2)正确;(3)摩尔质量在数值上等于其相对原子质量,也等于1mol原子含有的质量,所以该硫原子的摩尔质量是aNA g·mol-1,故(3)错误;(4)a g该氯原子的个数=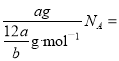
![]() ,一个氯原子中含有17个电子,所以a g该氯原子所含的电子数为
,一个氯原子中含有17个电子,所以a g该氯原子所含的电子数为![]() ,或者由于该氯原子的质量是a g,故ag该氯原子数目为1个,故含有电子数目为17,故(4)错误;故选B。
,或者由于该氯原子的质量是a g,故ag该氯原子数目为1个,故含有电子数目为17,故(4)错误;故选B。

【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO 等。现以硫酸渣制备铁红(Fe2O3),过程如下:

(1) 酸溶过程中Fe2O3与稀硫酸反应的离子方程式是_________________________。
(2) 还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:__________________________________________。检验Fe3+被完全还原的实验操作和现象是:________________________________________________。
(3) 氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:_____________________________________________。
(4) 生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是_____。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(5) 滤液B可以回收的物质有____________________________________________。



