��Ŀ����
����Ŀ�������������������������صĴ�����Ⱦ�����ͨ�����·���������
����ԭ�������������������ϰ�װһ����ת�������������·�Ӧ��
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
��l����֪��N2(g)+O2(g)![]() 2NO(g) ��H=+180kJ/mol
2NO(g) ��H=+180kJ/mol
��ѧ�� | O=O | C=O | C��O | N��N |
���ܣ�kJ/mol�� |
��Ӧ��2N0(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=________kJ/mol��
N2(g)+2CO2(g) ��H=________kJ/mol��
��2�����������̼�������ڴ��������¿ɷ�����Ӧ��2C0+2NO(g) ![]() N2+2CO2�������Ϊ1L���ܱ��ݻ��У�����0.80mol��CO��0.80 mol��NO����Ӧ��N2�����ʵ���Ũ�ȵı仯���������ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ��ʱ��NO��ƽ����Ӧ����v(NO)=______��
N2+2CO2�������Ϊ1L���ܱ��ݻ��У�����0.80mol��CO��0.80 mol��NO����Ӧ��N2�����ʵ���Ũ�ȵı仯���������ͼ��ʾ���ӷ�Ӧ��ʼ��ƽ��ʱ��NO��ƽ����Ӧ����v(NO)=______��

��3����CO2�ϳɶ����ѵĻ�ѧ��Ӧ�ǣ�2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ��H>0���ϳɶ�����ʱ���������������̼�����ʵ���֮��Ϊ4:l, CO2��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
CH3OCH3(g)+3H2O(g) ��H>0���ϳɶ�����ʱ���������������̼�����ʵ���֮��Ϊ4:l, CO2��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
��A����淴Ӧ����v��(CO2)_____B�������Ӧ����Ϊv��(CO2)���>������<���� ��=������
��4��SO2�����������������ա�����0.4molSO2������200mL 3mol��L-1NaOH��Һ������ȫ���գ�������Ϊ_____���ѧʽ�������ⶨ������Һ�����ԣ�����Һ������Ũ���ɴ�С��˳��Ϊ________��
��5��CO������ȼ�ϵ�أ���KOH��Һ������ʣ��������ֱ����CO�Ϳ��������������У�������Ӧ����ʽΪ��_________��
��6����֪������Fe(OH)3��Ksp=4.0��10-38����ij������þ��Һ��PH=9�������Һ��c(Fe3+)���Ϊ_________��
���𰸡� -751 0.05mol�qL-1�qmin-1 < Na2SO3��NaHSO3 c��Na+��>c��SO32-��>c��HSO3-��>c��H+��>c��OH-�� CO - 2e- + 4OH- = CO32- + 2H2O C��Fe3+��= 4.0��10��23
����������1��������̼Ϊֱ���ͽṹ�������д�������̼��˫����������̼�ĽṹʽΪO=C=O��ͼ���е�C��OΪCO����Ӧ�ʱ�=��Ӧ���ܼ���-�������ܼ��ܣ���N2��g��+O2��g��2NO��g����
��2NO��g��+2CO��g��2CO2��g��+N2��g������+�ڵã���2CO��g��+O2��g��2CO2��g�������2CO��g��+O2��g��2CO2��g������Ӧ�ʱ�=��Ӧ���ܼ���-�������ܼ��ܼ���÷�Ӧ���ʱ䣬����ͼ���е����ݿ�֪��H3=(497+2��1072-803��4) kJ/mol =-571kJ/mol�����ݸ�˹���ɣ���2CO��g��+O2��g��2CO2��g����H3=-571kJ/mol����N2��g��+O2��g��2NO��g����H=+180kJ/mol�����-�ٵã���2NO��g��+2CO��g��2CO2��g��+N2��g���������ʱ�ֵ��H2=��H3-��H1=-571 kJ/mol -180 kJ/mol=-751kJ/mol��
��2������ͼ���֪��Ӧ���е�4minʱ�ﵽƽ��״̬��������0.10mol/L����˸��ݷ���ʽ��֪����NO��0.20mol/L����NO��ƽ����Ӧ����v(NO)= 0.20mol/L��4min��0.05mol��L-1��min-1��
��3����A��û�дﵽƽ��״̬��B��ﵽƽ��״̬������A����淴Ӧ����v��(CO2)��B�������Ӧ����Ϊv��(CO2)��
��4������������0.6mol�� SO2��0.4mol�����ߵ����ʵ���֮����3��2������1��1��2��1֮�䣬�������������������ƺ����������ƵĻ����Ҷ��߾���0.2mol�����ⶨ������Һ�����ԣ���˵��������������ӵĵ���̶ȴ�������������ӵ�ˮ��̶ȣ�����Һ������Ũ���ɴ�С��˳��Ϊ��Na+��>c��SO32-��>c��HSO3-��>c��H+��>c��OH-����
��5��ԭ��صĸ�������ʧȥ���ӵ�������Ӧ����CO�ڸ���ͨ�룬�������Һ�Լ��ԣ�����Ӧ����ʽΪCO-2e-+4OH-=CO32-+2H2O��
��6����Һ��������Ũ����10��5mol/L�����Ը��������������ܶȻ�������֪��Һ��������Ũ����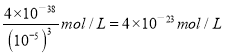 ��
��

 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�
