题目内容
【题目】已知氯化氢极易溶于水,标准状况下,1体积的水可以溶解500体积的氯化氢(HCl)气体,氯化氢的水溶液即为盐酸。
实验室现有质量分数为36.5%、密度为1.19gcm﹣3的浓盐酸,若用该浓盐酸配制0.4molL﹣1的稀盐酸220mL,试回答下列问题:
(1)配制该稀盐酸时,应选用的容量瓶的容积为(______).
A. 100mL B. 220mL C. 250mL D. 500mL
(2)计算需要____mL的浓盐酸,
(3)在量取浓盐酸后,进行了下列操作:
①待稀释盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中.
②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
③在盛蒸馏水的烧杯中注入盐酸,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)_____________。
(4)在下述配制过程中,配制的稀盐酸浓度将会偏高的是_________________;使浓度会偏低的是 _________________________。(填序号)
①未转移溶液前容量瓶中有少量的蒸馏水
②量取浓盐酸时俯视刻度线
③量取浓盐酸后用蒸馏水洗涤量筒
④若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
⑤定容时俯视刻度线
(5)在标准状况下,用一支收集满HCl气体的试管倒立在水槽中,水倒吸当充满试管时用塞子堵住试管口竖立(假设溶液不泄漏),则该溶液的溶质的物质的量浓度为_________________(保留两位小数)。
【答案】 C 8.4 ③①④② ③⑤ ②④ 1/22.4 mol/L或0.04mol/L。
【解析】(1)配制溶液时应该选用体积合适的容量瓶,实验室的容量瓶通常有:100mL、250mL、500mL、1000mL等几个规格,所以选C。
(2)配制0.4molL﹣1的稀盐酸220mL,实际用250mL容量瓶,需要HCl:0.4×0.25=0.1mol,质量为0.1×36.5=3.65g,所以需要的浓盐酸的质量为3.65÷36.5%=10g,体积为10÷1.19=8.4mL
(3)量取浓盐酸后,应该先稀释,冷却后转移到容量瓶,再洗涤,定容,摇匀。所以答案为③①④②。
(4)①未转移溶液前容量瓶中有少量的蒸馏水,对配制的结果应该是无影响,因为容量瓶不需要干燥,且还要向其中加入水以进行定容。
②量取浓盐酸时俯视刻度线,视线向下,会使加入的盐酸减少,所以浓度会偏低。
③量取浓盐酸后用蒸馏水洗涤量筒,量筒是不需要洗涤的,如果洗涤就会使量取的浓盐酸增加,浓度偏高。
④若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,会使沾在内壁上的HCl没有转移进容量瓶,使浓度偏低。
⑤定容时俯视刻度线,视线向下,会使加入的水减少,浓度偏高。
(5)设试管的总体积为VL,充满VL的HCl的物质的量为V/22.4mol,倒置水中,因为HCl的溶解度极大,所以最后水会充满试管,溶液体积为VL,浓度为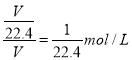

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】硫的氧化物、氮的氧化物是严重的大气污染物,可以通过以下方法处理:
催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
(l)已知:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O | N≡N |
键能(kJ/mol) |
则反应:2N0(g)+2CO(g)![]() N2(g)+2CO2(g) △H=________kJ/mol。
N2(g)+2CO2(g) △H=________kJ/mol。
(2)氮氧化物和碳氧化物在催化剂作用下可发生反应:2C0+2NO(g) ![]() N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=______。
N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=______。

(3)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
①A点的逆反应速率v逆(CO2)_____B点的正反应速率为v正(CO2)(填“>”、“<”或 “=”)。
(4)SO2可用氢氧化钠来吸收。现有0.4molSO2,若用200mL 3mol·L-1NaOH溶液将其完全吸收,生成物为_____(填化学式)。经测定所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为________。
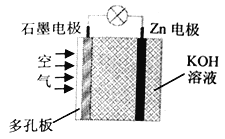
(5)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:_________。
(6)己知常温下Fe(OH)3的Ksp=4.0×10-38。若某氢氧化镁溶液的PH=9,则该溶液中c(Fe3+)最大为_________。