题目内容
【题目】利用焰色反应,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。下列说法中正确的是
A. 非金属单质燃烧时火焰均为无色
B. NaCl与Na2CO3灼烧时火焰颜色相同
C. 焰色反应均应透过蓝色钴玻璃观察
D. 只有金属单质灼烧时火焰才有颜色
【答案】B
【解析】试题分析:A.氢气在氧气中燃烧发出淡蓝色火焰,在氯气中燃烧发出苍白色火,焰故A错误;B.NaCl与Na2CO3灼烧时均表现钠元素的焰色反应颜色,火焰颜色均为黄色,故B正确;C.只有钾元素的焰色反应需要透过蓝色的钴玻璃片观察,防止钠元素的干扰,故C错误;D.焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特征的颜色的反应,故D错误。故选B。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案【题目】硫的氧化物、氮的氧化物是严重的大气污染物,可以通过以下方法处理:
催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
(l)已知:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O | N≡N |
键能(kJ/mol) |
则反应:2N0(g)+2CO(g)![]() N2(g)+2CO2(g) △H=________kJ/mol。
N2(g)+2CO2(g) △H=________kJ/mol。
(2)氮氧化物和碳氧化物在催化剂作用下可发生反应:2C0+2NO(g) ![]() N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=______。
N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=______。

(3)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
①A点的逆反应速率v逆(CO2)_____B点的正反应速率为v正(CO2)(填“>”、“<”或 “=”)。
(4)SO2可用氢氧化钠来吸收。现有0.4molSO2,若用200mL 3mol·L-1NaOH溶液将其完全吸收,生成物为_____(填化学式)。经测定所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为________。
(5)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:_________。
(6)己知常温下Fe(OH)3的Ksp=4.0×10-38。若某氢氧化镁溶液的PH=9,则该溶液中c(Fe3+)最大为_________。
【题目】已知:NH4++OH-![]() NH3↑+H2O,有一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl-中的几种,取该溶液进行如下实验:
NH3↑+H2O,有一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl-中的几种,取该溶液进行如下实验:
(1)填表(在表中的空白处填写离子符号)
步骤 | 实验步骤 | 肯定不存在的离子 |
① | 用pH试纸测得该溶液呈酸性 | ________________ |
② | 另取l0mL该溶液逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,此过程中无沉淀生成 | ________________ |
③ | 向②所得的溶液中加入足量Na2CO3溶液,过滤、洗涤、干燥,得到1.97g白色固体 | ________________ |
④ | 另取l0mL该溶液,加入浓NaOH溶液并加热,收集到224mL气体A(标准状况下) | |
⑤ | 另取l0mL该溶液,加入足量稀硝酸和AgNO3溶液,产生2.87g白色沉淀 |
(2)根据以上事实,在上述离子中,该溶液肯定存在的离子有________________。
(3)气体A溶于水可配成溶液A (该溶液的密度比水小),把50g浓度为c1的浓A溶液(溶质质量分数为ω1)与V mL水混合,得到浓度为c2的稀A溶液(溶质质量分数为ω2)。若ω1=2ω2,则:
①c1_____c2,②V_________50mL(填“>”“<”或“=”)。
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:
2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
SO2 压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
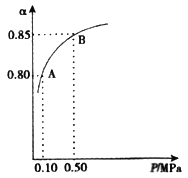
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。
① tl 时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是________。
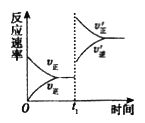
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
② 若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,______mol3)<______mol。