题目内容
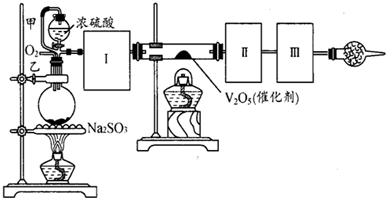
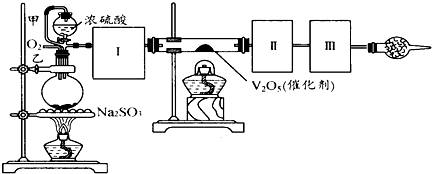
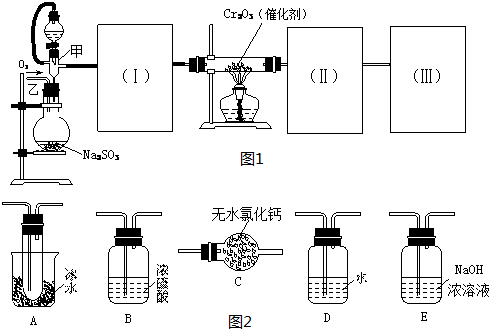
(18分)测定SO2转化成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑。
(已知SO3的熔点是16.8℃,沸点是44.8℃)
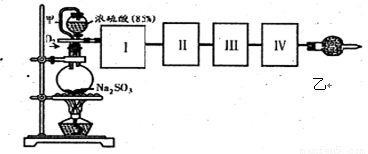
(1)装置中甲管的作用是 ;
乙装置的作用是 。
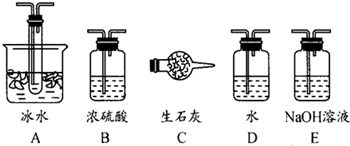
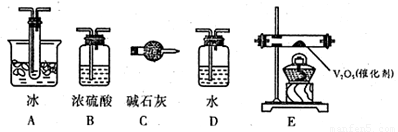
(2)根据实验需要,应该在I、II、Ⅲ、IV处连接合适的装置,请从下图A~E装置中选择最适合装置并将其序号填放下面的空格中。I、Ⅱ、Ⅲ、Ⅳ处连接的装置分别是 、 、 、 。
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 ,若用大火加热烧瓶时,SO2的转化率会 (填“升高”、“不变”或“降低”)。
(4)将SO2通入含1 mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为 。
(5)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅳ增重了mg,则实验中SO2的转化率为 。(用含m、n的代数式填写)
【答案】


【解析】略

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
 Na2SO4+SO2↑+H2O(注:80%H2SO4具有浓硫酸的特性)
Na2SO4+SO2↑+H2O(注:80%H2SO4具有浓硫酸的特性)