题目内容
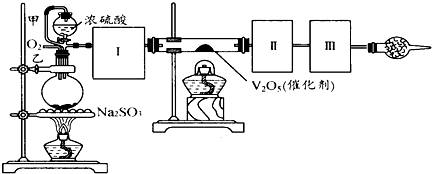
用下图装置可以进行测定SO2转化成SO3的转化率的实验.已知SO3的熔点是16.8℃,沸点是44.8℃.已知发生装置中所涉及反应的化学方程式为:Na2SO3(s)+H2SO4(85%)→Na2SO4+H2O+SO2↑
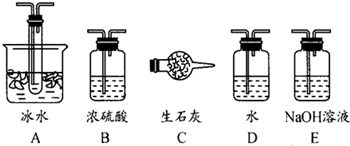
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置.请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中.
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在:①加热催化剂;②滴加浓硫酸的顺序中,应采取的操作是先
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你根据以下推测的原因说明相应的验证方法.
①Na2SO3已变质.验证方法
②甲中用稀H2SO4代替浓H2SO4.验证方法
(4)用a mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了b g,则实验中SO2的转化率为
分析:(1)可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,较低,可以用冰水来获得三氧化硫,可以用碱石灰或者氢氧化钠溶液进行尾气处理;
(2)先加热催化剂再滴入浓硫酸,能保证产生的二氧化硫尽可能多的转化为三氧化硫;根据温度升高平衡向吸热的方向移动;
(3)①根据Na2SO3变质变成Na2SO4,依据硫酸根离子的方法可检验是否变质;
②根据浓硫酸具有脱水性,而稀硫酸无此性质;
(5)根据S元素守恒计算消耗的SO2的物质的量,依据公式计算转化率.
(2)先加热催化剂再滴入浓硫酸,能保证产生的二氧化硫尽可能多的转化为三氧化硫;根据温度升高平衡向吸热的方向移动;
(3)①根据Na2SO3变质变成Na2SO4,依据硫酸根离子的方法可检验是否变质;
②根据浓硫酸具有脱水性,而稀硫酸无此性质;
(5)根据S元素守恒计算消耗的SO2的物质的量,依据公式计算转化率.
解答:解;(1)Ⅰ装置必须要对二氧化硫进行干燥,可以用浓硫酸来干燥二氧化硫气体;SO3的熔点是16,8℃,可以用冰水冷却来获得三氧化硫;未反应掉的二氧化硫对空气会产生污染,可以用碱石灰或者氢氧化钠溶液来进行尾气处理,故答案为:B; A;E(或C);
(2)为保证产生的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再滴入浓硫酸;SO2转化成SO3的过程为放热,升高平衡向逆向移动,转化率SO2的转化率会降低,
故答案为:①;②;降低;
(3)①Na2SO3变质变成Na2SO4,所以取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质,
故答案为:取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质;
②用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸,故答案为:用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸;
(4)根据硫原子守恒,Na2SO3~SO2~SO3,amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,应产生二氧化硫的质量为64ag,测得装置Ⅲ增重了bg,即为剩余二氧化硫的质量,所以参加反应的二氧化硫的物质的量为:64ag-bg转化率α=
×100%=
%,故答案为:
.
(2)为保证产生的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再滴入浓硫酸;SO2转化成SO3的过程为放热,升高平衡向逆向移动,转化率SO2的转化率会降低,
故答案为:①;②;降低;
(3)①Na2SO3变质变成Na2SO4,所以取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质,
故答案为:取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质;
②用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸,故答案为:用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸;
(4)根据硫原子守恒,Na2SO3~SO2~SO3,amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,应产生二氧化硫的质量为64ag,测得装置Ⅲ增重了bg,即为剩余二氧化硫的质量,所以参加反应的二氧化硫的物质的量为:64ag-bg转化率α=
| 64a-b |
| 64 |
| 1600a-25b |
| 16a |
| 1600a-25b |
| 16a |
点评:本题主要考查了二氧化硫的性质、计算以及离子的检验等知识,综合性较强,难度较大,考查学生分析和解决问题的能力.

练习册系列答案
相关题目
 Na2SO4+SO2↑+H2O(注:80%H2SO4具有浓硫酸的特性)
Na2SO4+SO2↑+H2O(注:80%H2SO4具有浓硫酸的特性)