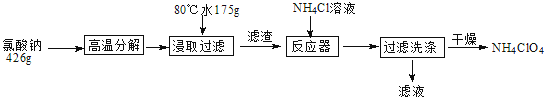
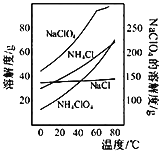
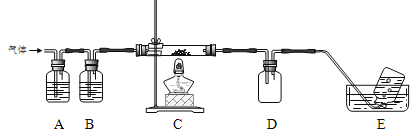
��Ŀ����
����Ŀ��һƿ��Һ�п��ܺ���Mg2+��Na+��OH����Cl����CO32����SO42����ij���֣��ֱַ�ȡ����Һ����װ����֧�Թܣ���������ʵ�飺
�����һ֧�Թ��НC���̪��Һ����Һ��죻
����ڶ�֧�Թ��м�������BaCl2��Һ�����ɰ�ɫ���������ˣ�������Һ�������֧�Թܣ��ڳ���������ϡ���ᣬ��������ʧ������ɫ��ζ���������������ͨ�����ʯ��ˮ��ʯ��ˮ����ǡ�
�������֧�Թ����ȼ��������ữ���ټ�����������Һ�����ְ�ɫ������ͨ������ʵ����ж���Һ�к�������Ϊ �������е�����Ϊ ����ȷ���Ƿ��е�����Ϊ ��д��ʵ��ڢ��������йط�Ӧ�����ӷ���ʽ�� ��
���𰸡�![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]()
Ba2+��CO32����BaCO3����![]()
![]() ��
��![]()
![]()
��������
��������������һ֧�Թ��НC���̪��Һ����Һ��죬˵����ҺΪ���ԣ�����OH������ΪMg2+��OH������Ӧ���ɳ������ܹ��棬˵��û��Mg2+�����ݵ���غ㣬��Һ��������ֻ����Na+��˵����Na+���ڼ�������BaCl2��Һ�����ɰ�ɫ�������ڳ����м���ϡ���ᣬ��������ʧ������ɫ��ζ���������������ͨ�����ʯ��ˮ��ʯ��ˮ����ǣ�˵������CO32����û��SO42����Cl����ȷ������Ϊ����ڼ�������BaCl2��Һʱ������Cl����
����ڼ�������BaCl2��Һʱ�����ķ�Ӧ��Ba2+��CO32����BaCO3�����ڳ����м���ϡ���ᣬ��������ʧ������ɫ��ζ��������������ķ�ӦΪ![]() ������������ͨ�����ʯ��ˮ��ʯ��ˮ����ǣ������ķ�ӦΪ
������������ͨ�����ʯ��ˮ��ʯ��ˮ����ǣ������ķ�ӦΪ![]() ��
��
����ۼ��������ữ����������Һ�е�OH����������кͷ�Ӧ������ʽΪ![]() ��������������Һ�����ְ�ɫ�����������ķ�ӦΪ
��������������Һ�����ְ�ɫ�����������ķ�ӦΪ![]() ��
��

 53���ò�ϵ�д�
53���ò�ϵ�д�����Ŀ�������жϣ�������ȷ����
ѡ�� | ��Ŀ | ���� |
A | �����л��������ϩ������ϩ���� | ����������ԭ�Ӿ���ͬһƽ�� |
B | �������ˮ���Ʊ������ɱ�ϩ��ˮ��Ӧ�Ʊ��� | ����ͬһ��Ӧ���� |
C | ��ϩ�ͱ�����ʹ��ˮ��ɫ | ��ɫ��ԭ����ͬ |
D | C4H9Cl��ͬ���칹����Ŀ(�����������칹) | ����4�� |
A. A B. B C. C D. D