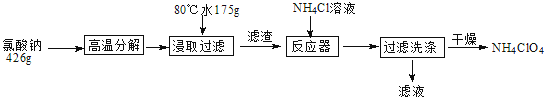
题目内容
【题目】右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。请回答下列问题。
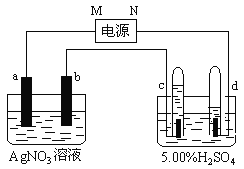
(1)直流电源中,N为 极。
(2)AgNO3溶液的浓度___________(填增大、减小或不变。下同),H2SO4溶液的pH ,若要硫酸恢复成原溶液需加入
(3)Pt电极上生成的物质是 ,其质量为 g。
【答案】(1)负;(2)不变;减小;水;(3)Ag;2.16。
【解析】
试题分析:(1)电解硫酸,实际上电解水,阴极:2H++2e-=H2↑,阳极:2OH--4e-=H2O+O2↑,得失电子数目守恒,阴极上得到气体多,即d为阴极,c为阳极,N为负极,M为正极;(2)硝酸银溶液,a极上:Ag-e-=Ag+,b极上,Ag++e-=Ag,得失电子数目守恒,硝酸银的浓度不变,电解硫酸实际上电解水,因此浓度增大,若要恢复成原溶液,需加入水;(3)根据(2)的分析,b上得到是Ag,设生成氢气的物质的量为xmol,根据电极反应式,推出生成氧气的物质的量为x/2mol,因此有x+x/2=336×10-3/22.4,x=0.01mol,此电路是串联电路,因此b极上产生m(Ag)=0.01×2×108g=2.16g。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】以下判断,结论正确的是
选项 | 项目 | 结论 |
A | 三种有机化合物:丙烯、氯乙烯、苯 | 分子内所有原子均在同一平面 |
B | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | 属于同一反应类型 |
C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
D | C4H9Cl的同分异构体数目(不考虑立体异构) | 共有4种 |
A. A B. B C. C D. D