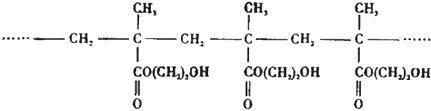
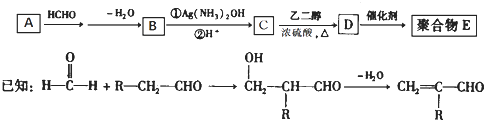
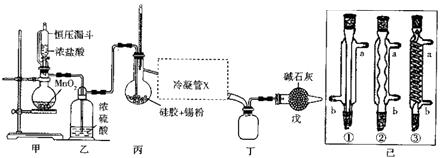
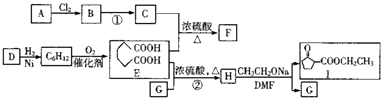
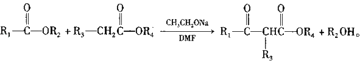
题目内容
【题目】向含Fe2(SO4)3、CuCl2、H2SO4的混合溶液中投入足量的Fe粉,充分反应后,剩余的固体物质经干燥,称得其质量比加入的铁粉质量减轻16g,此时溶液中c(Fe2+)是原混合液中c(Cu2+)的3倍(反应前后体积没有变化),溶液中c(SO42﹣)与c(Cl﹣)之比是( )
A.1:2
B.2:1
C.1:3
D.1:1
【答案】D
【解析】解:反应前固体为铁,设其物质的量为x,反应后只有铜,设其物质的量为y,
依据质量关系列式得到(1)56x﹣64y=16g,
由于氧化还原反应过程中存在电子守恒,铁总共失去电子数2x,铜离子得到2y个电子,剩下的电子最终都是在二价铁离子中,可知溶液最后的二价铁离子的量 ![]() +x=2x﹣y,
+x=2x﹣y,
而已知反应后二甲铁离子与反应前铜离子的比例为3:1,(2)(2x﹣y):y=3:1,
联立(1)56x+64y=16g(2)(2x﹣y):y=3:1
计算得到y= ![]() ,2x﹣y=1,
,2x﹣y=1,
由氯化铜中元素守恒和氯元素的量为2y= ![]() ,
,
电荷守恒可知硫酸根离子物质的量[2(x﹣y)×2﹣ ![]() ]×
]× ![]() =
= ![]() ,
,
硫酸根离子和氯离子物质的量之比为1:1,
故选D

练习册系列答案
相关题目