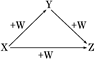
题目内容
下列两种物质间发生反应,消耗等物质的量的酸,产生气体最多的是
| A.木炭与浓硝酸 | B.铜与稀硝酸 | C.锌与稀硫酸 | D.木炭与浓硫酸 |
D
解析试题分析:设酸的物质的量为1mol,分别根据4个反应的化学方程式可以求出产生气体的物质的量。木炭与浓硝酸:C+4HNO3=CO2↑+4NO2↑+2H2O,产生的气体为1.25mol;铜与稀硝酸:Cu+8HNO3=3Cu(NO3)2
+2NO↑+4H2O,产生的气体为0.25mol;锌与稀硫酸:Zn+H2SO4=ZnSO4+H2↑,产生的气体为1mol;D、木炭与浓硫酸:C+2H2SO4 CO2↑+2SO2↑+2H2O,产生的气体为1.5mol,故D项正确。
CO2↑+2SO2↑+2H2O,产生的气体为1.5mol,故D项正确。
考点:本题考查根据化学方程式的计算。

练习册系列答案
相关题目
溴被称为“海洋元素”。溴的元素符号是
| A.B | B.Be | C.Br | D.Bi |
下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 | 稀硝酸氧化性比浓硝酸强 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
下列有关实验现象和解释或结论都正确的是
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 N2O4的 N2O4的 H<0 H<0 |
| B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色 和紫红色 | 还原性:I->Br->Fe2+ |
| C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
使0.15mol MnO2与过量的12mol·L-1的浓盐酸反应,使50mL 12mol·L-1的浓盐酸与足量MnO2反应,两者产生的氯气相比(其他条件相同)
| A.一样多 | B.前者较后者多 | C.后者较前者多 | D.无法比较 |
下列物质都具有较强的吸水性。欲使稀硝酸成为浓硝酸,不能使用的试剂是
| A.浓硫酸 | B.五氧化二磷 | C.无水硫酸镁 | D.甘油 |
关于下列各实验装置的叙述中,不正确的是
| A.装置①可用于实验室制取少量NH3或O2 |
| B.可用从a处加水的方法检验装置②的气密性 |
| C.实验室可用装置③收集H2、NH3 |
| D.利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜 |
材料与化学密切相关,表中对应关系错误的是( )。
| 选项 | 材料 | 主要化学成分 |
| A | 刚玉、金刚石 | 三氧化二铝 |
| B | 大理石、石灰石 | 碳酸钙 |
| C | 普通水泥、普通玻璃 | 硅酸盐 |
| D | 沙子、石英 | 二氧化硅 |