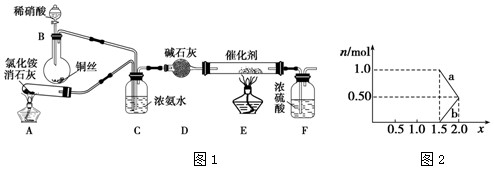
题目内容
3.若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为$\frac{1000Vd}{22400+36.5V}$mol/L.分析 根据n=$\frac{VL}{22.4L/mol}$计算出标准状况下V L HCl气体的物质的量,然后根据m=nM计算出HCl的质量,1L水的质量约为1000g,从而可知所得溶液的质量,再根据V=$\frac{m}{ρ}$计算出所得溶液的体积,最后根据c=$\frac{n}{V}$计算出该溶液的物质的量浓度.
解答 解:标准状况下VL HCl的物质的量为:n(HCl)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,该HCl的质量为:m(HCl)=36.5g/mol×$\frac{V}{22.4}$mol=$\frac{36.5V}{22.4}$g,1L水的质量约为1000g,则所得溶液的质量为:$\frac{36.5V}{22.4}$g+1000g=(1000+$\frac{36.5V}{22.4}$)g,
该溶液的体积为:$\frac{(1000+\frac{36.5V}{22.4})g}{dg/mL}$=$\frac{22400+36.5V}{22.4d}$mL,
所以该溶液的物质的量浓度为:c(HCl)=$\frac{n}{V}$=$\frac{\frac{V}{22.4}mol}{\frac{22400+36.5V}{22.4d}×1{0}^{-3}L}$=$\frac{1000Vd}{22400+36.5V}$mol/L,
故答案为:$\frac{1000Vd}{22400+36.5V}$mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算所得溶液体积为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
13.下列有关Na2CO3和NaHCO3性质的比较中,正确的是( )
| A. | 与稀盐酸反应放出气体的快慢:Na2CO3>NaHCO3 | |
| B. | 配制成同物质的量浓度的溶液时,溶液的pH:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3 | |
| D. | 在Na2CO3和NaHCO3的稀溶液中,加CaCl2溶液都有白色沉淀生成 |
8.甲烷的燃烧热△H=-890.3kJ•mol-1,1kg CH4在25℃,101kPa时充分燃烧生成液态水放出的热量约为( )
| A. | -5.56×104 kJ•mol-1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |

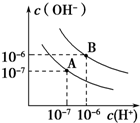 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: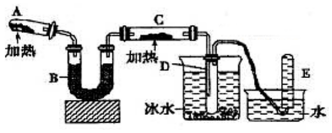 己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.