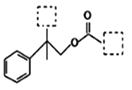
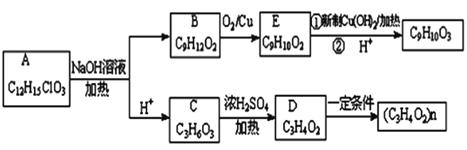
题目内容
【题目】铁在人体中的含量只有0.004%,微乎其微,但铁是组成血红蛋白的一个不可缺少的成员.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁,服用维生素C,可使食物中的Fe3+还原成Fe2+ , 有利于人体吸收.
(1)在人体中进行Fe2+ ![]() Fe3+的转化时,①中的Fe2+作剂;
Fe3+的转化时,①中的Fe2+作剂;
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作剂;
(3)用小苏打片(NaHCO3)治疗胃酸(主要成分盐酸)过多的离子方程式为;如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为 .
【答案】
(1)还原
(2)还原
(3)HCO3﹣+H+═CO2↑+H2O;Al(OH)3+3H+═Al3++3H2O
【解析】解:(1)该反应中Fe元素化合价由+2价变为+3价,还原剂失电子化合价升高,所以亚铁离子作还原剂,故答案为:还原;(2)该反应中Fe元素化合价由+3价变为+2价,则铁离子作氧化剂,需要还原剂才能实现,所以维生素C是还原剂,故答案为:还原;(3)碳酸氢钠和稀盐酸反应生成NaCl、二氧化碳和水;氢氧化铝和稀盐酸反应生成氯化铝和水,离子方程式分别为HCO3﹣+H+═CO2↑+H2O、Al(OH)3+3H+═Al3++3H2O,故答案为:HCO3﹣+H+═CO2↑+H2O;Al(OH)3+3H+═Al3++3H2O. (1)该反应中Fe元素化合价由+2价变为+3价,还原剂失电子化合价升高;(2)该反应中Fe元素化合价由+3价变为+2价,则铁离子作氧化剂,需要还原剂才能实现;(3)碳酸氢钠和稀盐酸反应生成NaCl、二氧化碳和水;氢氧化铝和稀盐酸反应生成氯化铝和水.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________。
(2)同浓度的CH3COO-、HCO、CO![]() 、ClO-结合H+的能力由强到弱的顺序为_____________。
、ClO-结合H+的能力由强到弱的顺序为_____________。
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是________________________________。