题目内容
4.已知一定量Ca(OH)2固体溶于水后,存在以下平衡状态:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),Ksp=4.7×10-6 mol3/L3,下列措施可使Ksp增大的是( )| A. | 升高温度 | B. | 降低温度 | ||
| C. | 加入适量CaO固体 | D. | 加入适量Na2CO3固体 |
分析 Ksp只与难溶电解质的性质和温度有关,大多数电解质的Ksp随温度的升高而增大,但个别物质如Ca(OH)2,其Ksp随温度的升高而降低.
解答 解:难溶物的溶度积Ksp只与难溶电解质的性质和温度有关,故C、D错误;
氢氧化钙随着温度的升高,其溶解度减小,则升高温度,氢氧化钙的溶度积Ksp较小,降低温度,其溶度积Ksp增大,故A错误、B正确,
故选B.
点评 本题考查了难溶电解质的溶解平衡及其影响,题目难度中等,注意掌握难溶物溶度积影响因素,特别需要明确升高温度后氢氧化钙的溶度积反而减小,为易错点.

练习册系列答案
 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
14.将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)+2M(s)?2Z(g);△H<0.当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 升高温度 | 逆反应速率增大 量大于正反应速率增大量 | X的体积分数变大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入一定量Z | 逆反应速率增大 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
15.下列叙述正确的是( )
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到该元素的单质 | |
| C. | H2O2既有氧化性又有还原性 | |
| D. | 分解反应和置换反应均属于氧化还原反应 |
12.下列有关钠的叙述中,错误的是( )
| A. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 | |
| B. | 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 | |
| C. | Na与Na+都具有强的还原性 | |
| D. | 钠的质地软,可用小刀切割 |
19.下列叙述中不正确的是( )
| A. | 电解池的阳极上发生氧化反应,阴极上发生还原反应 | |
| B. | 原电池跟电解池连接后,电子从原电池负极流向电解池阴极 | |
| C. | 电镀时,电镀池里的阳极材料发生氧化反应 | |
| D. | 电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气 |
9.下面实验操作可以实现实验目的是( )
| A. | 将SO2通入KMnO4溶液中,溶液褪色,证明SO2具有漂白性 | |
| B. | 取样灼烧,可以鉴别某白色纺织品是棉织品还是羊毛制品 | |
| C. | 动物油中主要成分是不饱和高级脂肪酸甘油酯 | |
| D. | 取少量蔗糖溶液加稀硫酸,水浴加入几分钟后,再加入新制的氢氧化铜悬浊液并加热,观察现象,判断蔗糖水解产物中是否有葡萄糖 |
16.某有机物能跟新制的氢氧化铜反应生成红色沉淀,相对分子质量为44.燃烧该有机物2.2g生成2.24L(标准状况下)CO2.下列说法不正确的是( )
| A. | 该有机物属于醛类 | |
| B. | 燃烧该有机物4.4 g,生成1.8g水 | |
| C. | 1 mol该有机物一定条件下能与l mol H2加成 | |
| D. | 0.01 mol该有机物与足量银氨溶液充分反应,析出金属银2.16 g |
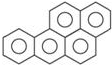 苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )
苯并[α]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照标准),其结构式中有5个环互相并合,如图.每个碳原子上都有一个双键(C=C),分子中共有m个双键,五个环都处在同一个平面上,分子中可能同时处于同一个平面上的原子数为n个,则m、n分别等于( )