题目内容
3.工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O①4NO+3O2+2H2O=4HNO3②
(1)现以1.7吨液氨为原料来生产质量分数为50%的硝酸,理论上至少需要加水的质量为4.5吨.(假设生产过程中反应物和生成物均无损耗)
(2)工业上用Mg(NO3)2替代浓H2SO4可作为制取浓HNO3的脱水剂,现有50%(质量分数,下同)的硝酸M1吨,向其中加入80%的Mg(NO3)2溶液M2吨,蒸馏分离得到90%的硝酸和60%的Mg(NO3)2溶液(不含HNO3).若蒸馏过程中HNO3、Mg(NO3)2、H2O均无损耗,则蒸馏前的投料比$\frac{{M}_{1}}{{M}_{2}}$=0.75.
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3═NaNO2+NaNO3+CO2③,NO+NO2+Na2CO3═2NaNO2+CO2④.现用足量的纯碱溶液来吸收硝酸工业尾气(NO和NO2),每产生22.4L(标准状况下)CO2时,吸收液质量增加44g.
求硝酸工业尾气中NO和NO2的物质的量之比?
分析 (1)根据总反应方程式:4NH3+8O2=4HNO3+4H2O,即NH3+2O2=HNO3+H2O来计算;
(2)根据蒸馏过程中被蒸馏的水的质量,分别找出硝酸与硝酸镁中转移的水的等量关系,分别求出 M1、M2,进行分析解答本题;
(3)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
解答 解:(1)把两个化学方程式相加:得:4NH3+8O2=4HNO3+4H2O,再去掉一个公约数4简化为:
NH3 +2O2 =HNO3 +H2O
17 63 18
1.7t X Y
X=6.3t Y=1.8t
质量分数要为50%,则整个溶液的质量为6.3吨/50%=12.6吨,所需要加的水的质量为:12.6-6.3-1.8=4.5吨,
故答案为:4.5;
(2)设被转移的水的质量为X,
50%的硝酸含水量为50%,80%的硝酸镁溶液含水量为20%,90%的硝酸含水量为10%,60%的硝酸镁溶液含水量为40%.则
硝酸中水:0.5M1-X=(M1-X)×0.1
解得:M1=$\frac{9}{4}$X
硝酸镁中水:0.2M2+X=(M2+X)×0.4
解得:M2=3X
故$\frac{{M}_{1}}{{M}_{2}}$=$\frac{9X}{4×3X}$=$\frac{3}{4}$=0.75,
故答案为:0.75;
(3)设NO的物质的量是x,NO2的物质的量是y,则
x+$\frac{y-x}{2}$=$\frac{22.4}{22.4}$mol=1mol;
32x+24(y-x)=44,
解得:x=$\frac{1}{4}$mol,y=$\frac{7}{4}$mol,即一氧化氮和二氧化氮的物质的量之比$\frac{\frac{1}{4}}{\frac{7}{4}}$=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,
故答案为:1:7.
点评 本题主要考查了化学计算,注意平时知识的积累以及灵活应用是解题的关键,难度中等.

①金属性最强的是铯
②它们的氧化物都只有M2O和M2O2两种形式
③在自然界中均以化合态形式存在
④密度按Li→Cs 顺序依次递增
⑤离子半径:Rb+>K+>Na+.
| A. | ①②③ | B. | ③④⑤ | C. | ②④⑤ | D. | ①③⑤ |

粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,提纯的步骤有:①加入过量的Na2CO3溶液; ②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;④加入适量盐酸; ⑤溶解; ⑥过滤; ⑦蒸发.
其正确的操作顺序是( )(填写序号字母).
| A. | ⑤②③①⑥④⑦ | B. | ⑤①②③⑥④⑦ | C. | ⑤②①③④⑥⑦ | D. | ⑤③②①⑥④⑦ |
| A. | 20gD2O中含有的中子数为10NA | |
| B. | 0.1molCl2与足量的NaOH溶液反应,转移的电子数为0.2NA | |
| C. | 常温下,pH=13 的NaOH溶液中含有的OH-数为0.1NA | |
| D. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA |
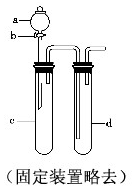 铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.
铜与稀硝酸反应产生NO,NO又被氧化成NO2,对实验观察无色NO有干扰,过多的NO、NO2又会污染环境,改进实验的涉及符合绿色化学的思想.有兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化.(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的在于检验装置气密性;
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;再由a向c中加2mL蒸馏水,c中实验现象为反应变缓,气体颜色变浅;
(3)表中是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是丙,理由是制取等量的硝酸铜时,丙方案耗酸量最少,无污染.
| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
| A. | 加入适量6mol•L-1的盐酸 | B. | 加入少量醋酸钠固体 | ||
| C. | 加入少量铜粉 | D. | 加入少量金属钠 |
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数为0.3 NA | |
| D. | 1 mol Na2O2与足量CO2反应转移的电子数2NA |
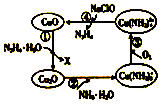 水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.
水合肼(N2H4•H2O)又称水合联氨,其纯净物为无色透明的油状液体,具有强碱性和吸湿性.将水合肼通入CuO胶体中,可发生如图所示的转化.
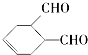 中含氧官能团的名称是醛基
中含氧官能团的名称是醛基 OHCCH=CHCHO+2H2O.
OHCCH=CHCHO+2H2O. .
.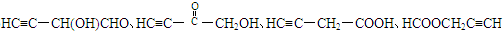 、HC≡CCOOCH3.
、HC≡CCOOCH3.